신약 개발과 생성 AI


신약 개발과 생성 AI
많은 산업 분야에서 생성 AI가 큰 주목을 받고 있습니다. 신약 개발도 예외가 아닙니다. ChatGPT가 문장을 생성하는 AI라면 신약 개발에서 생성 AI는 신약후보물질의 분자구조나 단백질 서열 및 3차원 구조를 생성합니다. 주어진 후보물질의 물성을 예측하는 것을 넘어 원하는 성질을 갖는 후보물질을 생성할 수 있기 때문에 신약 개발에서 AI의 활용성을 극적으로 높여줍니다.
제약 바이오 업계의 반응과 관심도 뜨겁습니다. 글로벌 컨설팅사 KPMG가 전 세계 118개 생명과학 CEO를 대상으로 한 설문조사에 따르면 62%의 응답자가 수익성 개선을 위한 생성 AI가 조직의 최우선 투자 순위라고 답변했습니다.
알파폴드3 - 단백질, RNA, DNA
여러 생성 AI들이 다양하게 연구되고 있습니다. 가장 활발하게 연구되는 분야 중 하나는 단백질 서열 및 3차원 구조 생성과 분자구조 디자인입니다. 단백질 관련 가장 대표적인 생성 AI는 알파폴드 3입니다.
알파폴드3는 단백질, RNA, DNA 등의 서열 정보로 부터 3차원 결합 구조를 생성합니다. 알파폴드3는 Diffusion 방법을 바탕으로 무작위로 흩뿌려진 원자들의 위치에서 시작해 정답 원자 위치를 복원하는 방식으로 3차원 구조를 생성합니다. 결과는 놀랍습니다. 70%-90%의 타깃에 대해서 바르게 구조를 생성할 수 있습니다. 알파폴드 3의 자세한 내용이 궁금하다면 여기를 참고해 주세요.
RFdiffusion(RF디퓨전)
생성 AI는 주어진 서열로부터 3차원 구조를 생성하는 것을 넘어 원하는 형태를 보이는 단백질의 3차원 구조와 서열을 동시에 생성할 수 있습니다. 이 분야에서 가장 선도적인 연구자 중 한 명은 데이비드 베이커입니다. 아래 동영상은 이 연구그룹에서 만든 RFdiffusion (Nature volume 620, pages1089–1100 (2023))을 이용하여 단백질을 설계하는 과정을 보여줍니다.
알파폴드3와 마찬가지로 Diffusion 방법을 사용하여 임의로 흩뿌려져 있는 원자들로부터 원하는 단백질 구조가 생성됩니다. p53은 MDM2라는 단백질에 결합하는 신호분자입니다. 베이커 그룹에서는 RFdiffusion으로 MDM2에 결합할 수 있는 단백질 구조를 디자인한 후 실험을 통해 MDM2와 결합여부를 측정하였습니다. 그 결과 1,000개 중 절반 이상이 p53에 비해 1,000배 이상 강하게 결합하였습니다. 항상 이렇게 RFdiffusion이 성공적으로 작동하는 것은 아닙니다. 통상적으로 성공률은 10-20% 정도입니다. 하지만 기존 방법의 1% 성공률에 비하면 훨씬 높은 수치입니다.

분자 생성 AI
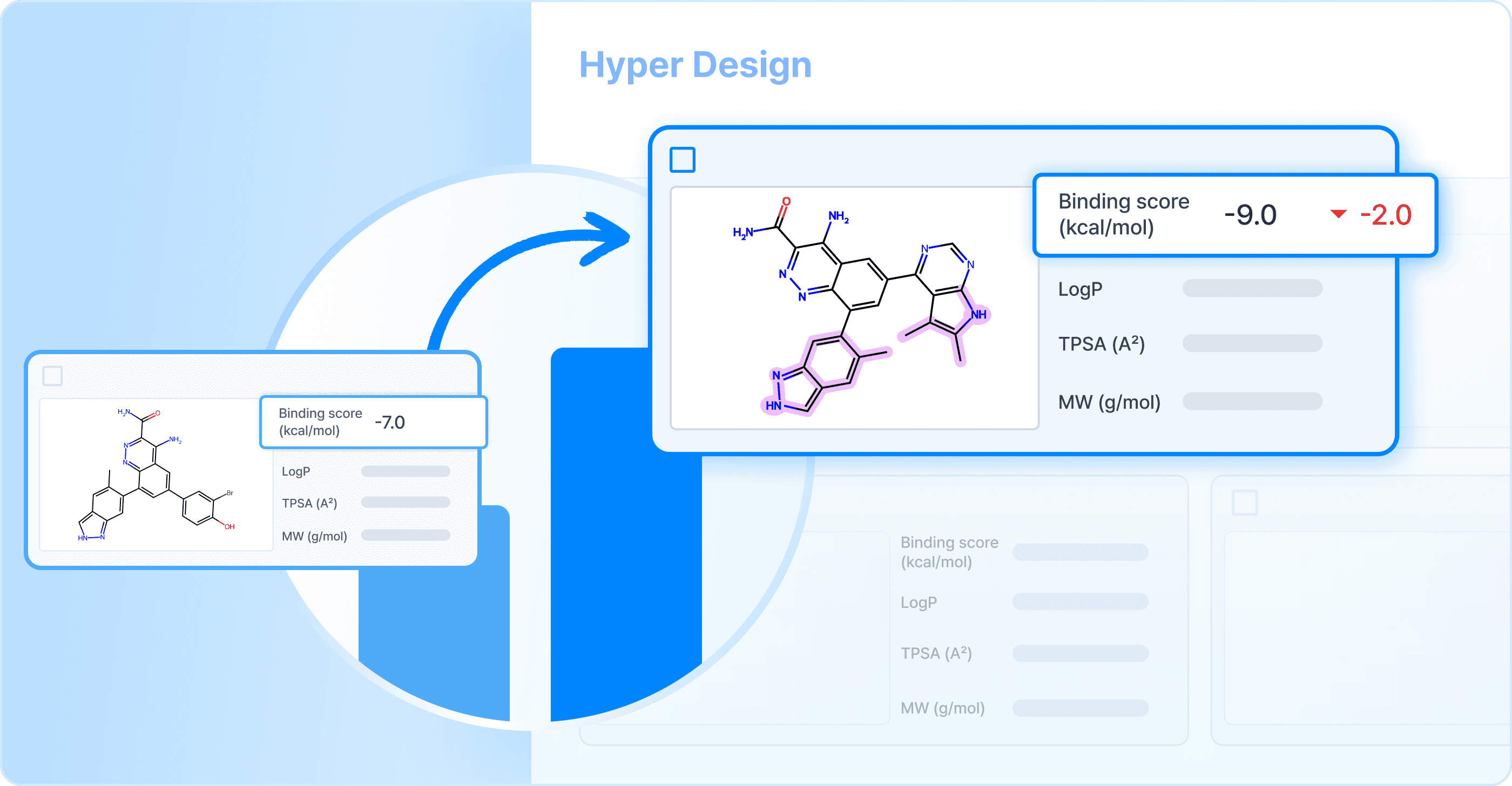
히츠에서도 여러 생성 AI 연구를 진행하고 있습니다. 저희의 주요 관심사는 분자구조 디자인입니다. 아래와 같이 주요 논문들을 발표했으며 이렇게 개발된 기술들은 하이퍼랩에 탑재되어 있습니다. 하이퍼랩에서는 Reference 분자구조를 입력한 후 변경하고 싶은 부분을 선택하면 AI가 신규한 분구조를 디자인하여 제공해 줍니다.
이렇게 디자인한 분자들은 Reference 분자들보다 활성이 더 높을 것으로 예측되는 분자들입니다. 히츠에서 분자 생성 AI기술을, 실험을 통해서 검증하였습니다. L사와의 공동연구에서는 기존 1년 동안 2종의 유효물질을 발굴했는데 히츠의 생성 AI기술을 적용한 후에는 6개월 동안 15종의 유효물질을 발굴하였습니다. B사와의 공동연구에서는 in vivo에서 유효한 후보물질 3종을 발굴하였습니다.
생성 AI는 신약 개발의 연구효율을 높일 수 있는 게임체인저로 많은 주목을 받고 있습니다. 생성 AI를 연구과제에 적용하여 연구효율 향상을 경험하시길 바랍니다.