EFMC-ISMC 2024 세션 살펴보기


안녕하세요, 이번에는 EFMC-ISMC 2024 학회 세션에 대해서 미리 살펴보겠습니다.
EFMC-ISMC2024는 9월 1일부터 5일까지 이탈리아 로마에서 열리는 국제 의약화학 심포지엄으로, Chemical Biology, Drug Discovery Projects, Technologies 등 크게 세 가지 세션으로 나뉩니다.
| Topic | Session | Title |
|---|---|---|
| Chemical Biology | 1 | Tackling “Difficult-to-Drug”-Targets with Chemical Biology Approaches |
| 4 | Targeting RNA and RNA-Regulatory Proteins | |
| 8 | Chemically Induced Proximity Approaches for Therapeutic Intervention | |
| Drug Discovery Projects | 2 | Drug Discovery Beyond the Rule of Five |
| 5 | Early Integration of Translational Strategies into Discovery Projects | |
| 9 | Trends in Peptide Drug Discovery | |
| Technologies | 3 | Novel Methodologies in Photo- and Electrochemistry |
| 6 | DNA-Encoded Libraries / ACSMEDI Session | |
| 10 | Computational Chemistry and Computational Biology in Drug Discovery |
Chemical Biology
Tackling “Difficult-to-Drug”-Targets with Chemical Biology Approaches
Next-Generation Covalent Drug Discovery (LE001)
Covalent docking, Kinome-wide activity
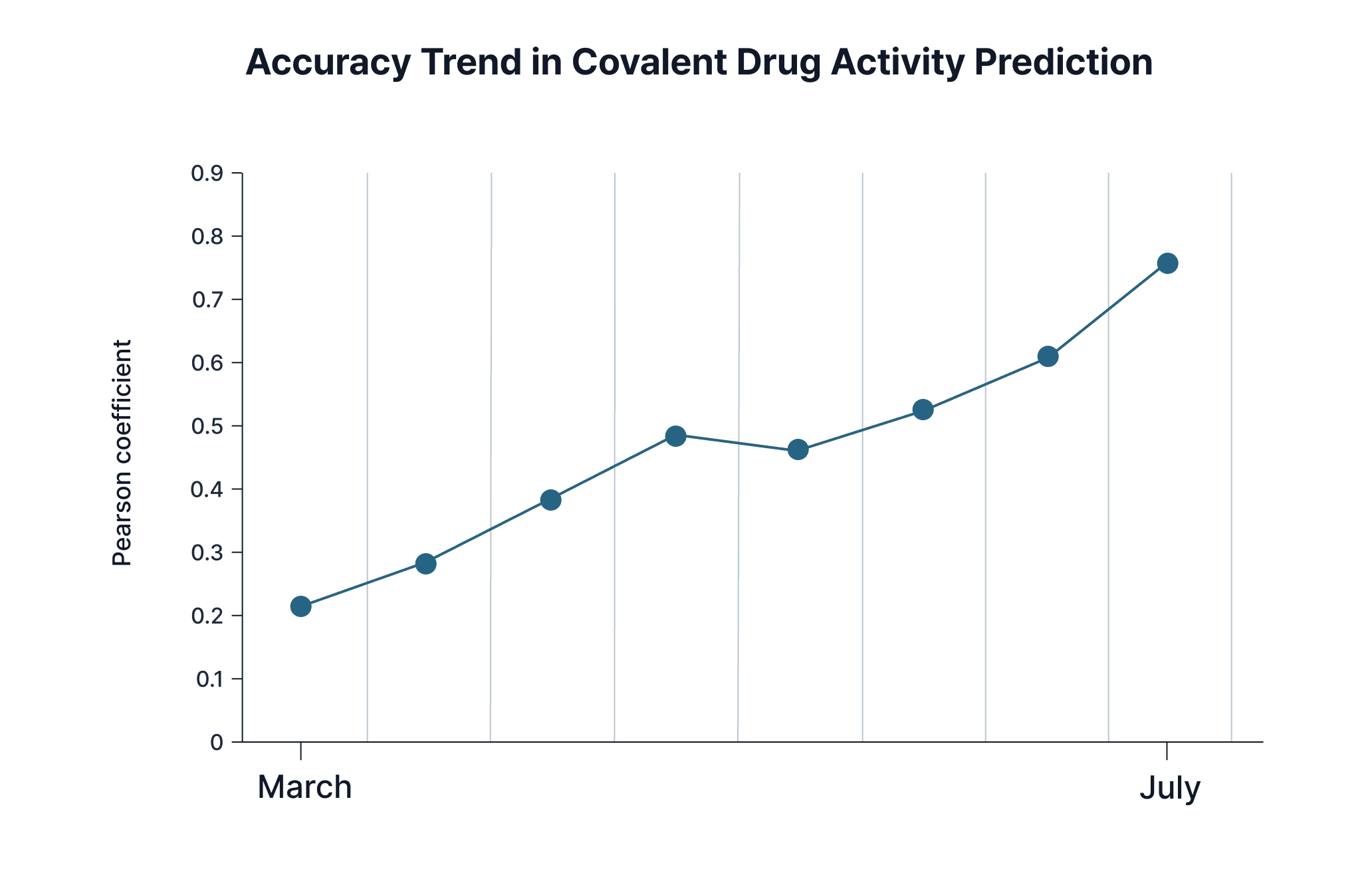
Covalent drug는 원래 부작용 예측이 어렵고 기술이 부족해 약물 개발이 어려웠습니다. 하지만 근 10년간 결정학, 계산/유기 화학, 생물 정보학 등의 발전으로 covalent drug는 지난 10년 동안 꾸준히 매년 FDA 승인 약물의 2%에서 최대 11%까지 차지하기도 했습니다. 최근 PROTAC에서도 covalent warhead를 사용하는 연구들이 증가하며, 신규 모달리티에서도 공유 결합 약물 개발에 대한 중요성은 갈수록 높아지고 있습니다.
히츠에서는 이런 연구 트렌드에 발맞춰 covalent drug의 활성 예측 모델 또한 개발하고 있습니다. 현재 R2 = 0.7로 무려 4개월 만에 이뤄낸 성과입니다. 계속해서 성능을 발전시켜 올해 말에 하이퍼 랩에도 탑재할 예정입니다. 하나의 저해제가 kinome wide로 어떤 kinase들에서 활성을 보이는지 예측해 선택성을 개선하는 데 도움이 되는 프로그램도 올해 안에 출시될 예정입니다.
Targeting RNA and RNA-Regulatory Proteins
Hit Discovery for Riboswitches as Targets for Antibiotics (LE014)
Riboswitches
Riboswitch는 mRNA 분자의 일부로, 작은 분자가 결합함으로써 mRNA의 발현을 직접적으로 조절하는 기능을 합니다. Riboswitch는 세포 내에서 특정 대사산물이 작은 분자와 결합해 유전자 발현을 조절합니다. Riboswitch는 크게 두 부분으로 나뉩니다. 특정 작은 분자와 결합하는 aptamer domain과 small molecule이 aptamer domain에 결합했을 때 구조적 변화를 일으켜 유전자 발현을 조절하는 expression platform으로 구성됩니다.
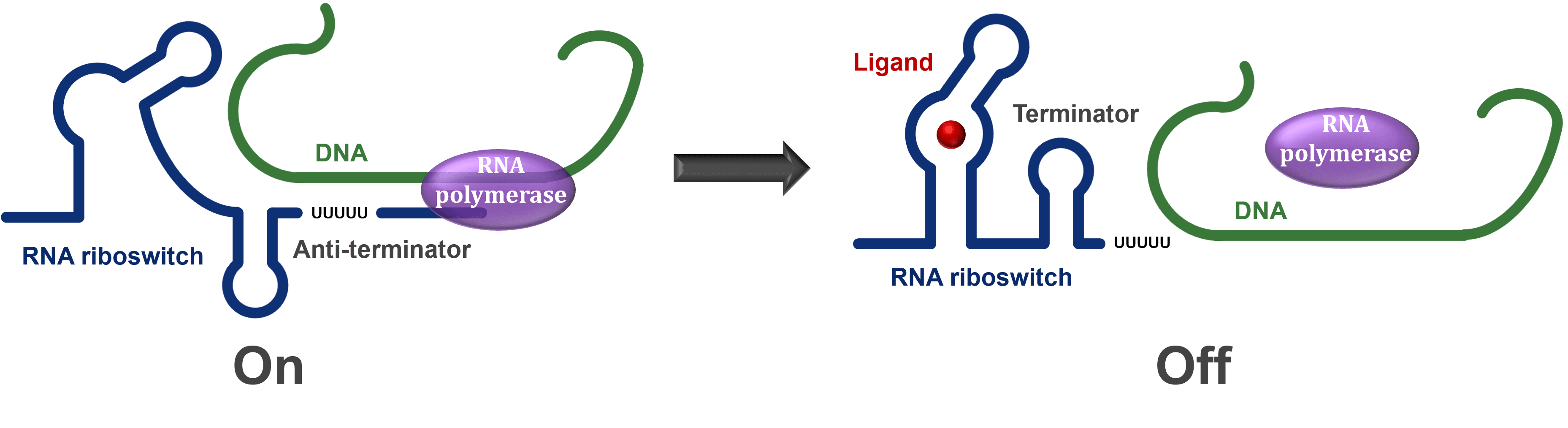
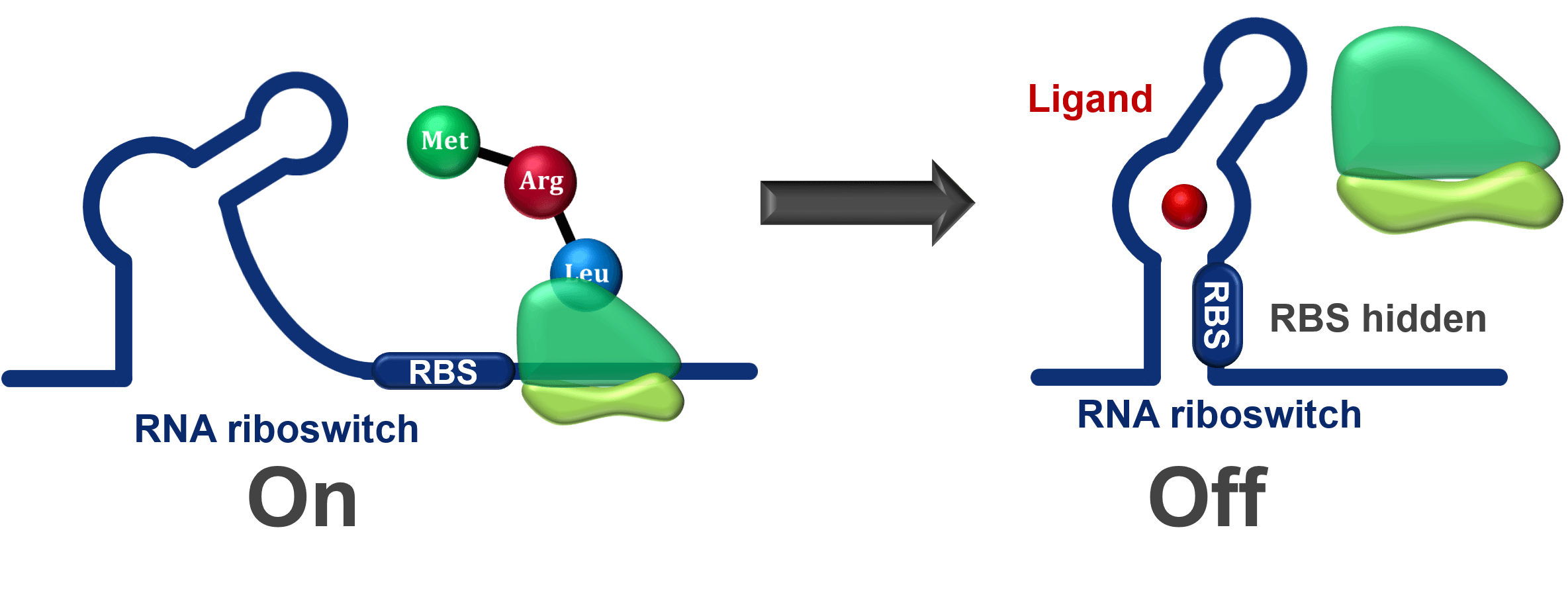
Riboswitch는 특히 세균에서 많이 연구되었으며, 새로운 항생제 개발로 주목을 받고 있습니다. 많은 박테리아는 필수 유전자를 조절하는 riboswitch를 가지고 있는데요, 티아민 파이로인산(TPP) 리보스위치는 티아민 생합성 및 수송을 담당하는 유전자를 조절합니다. 이는 저분자에 의해 억제되어 박테리아의 성장을 억제해 새로운 종류의 항생제를 개발할 가능성을 확인했습니다.
Structure-Based Design of a Potent and Selective YTHDC1 Ligand (LE016)
YTHDC1 Ligand
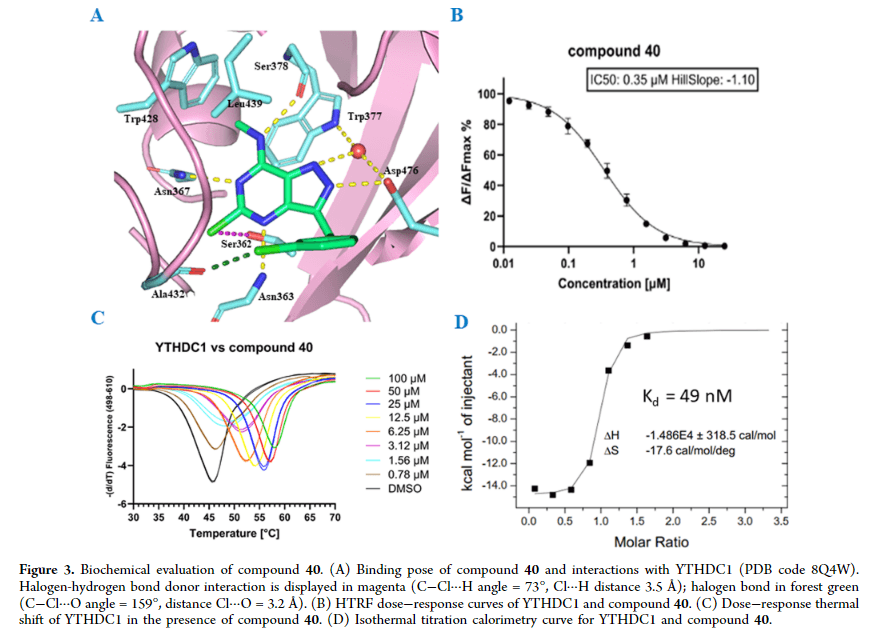
N6-아데노신 메틸화(m6A)는 mRNA의 post-transcriptional modification (전사 후 변형)으로 알려져 있으며, YTHDC1은 세포핵에서 이 변형을 인식하는 단백질입니다. 연사분은 단백질 구조 기반 설계를 통해 49nM Kd를 보이는 YTHDC1 억제제를 개발하셨는데요, 이는 PDB ID 8Q4W (1.6Å 해상도)로 결합 구조 또한 검증되었습니다. compound 40은 세포질 m6A-RNA 리더인 YTHDF1-3 및 YTHDC2에 선택적으로 반응하며 급성 골수성 백혈병(AML) 세포주에서 anti-proliferation 활성을 나타냅니다. compound 40에서 유래된 derivatives는 enzyme 수준에서의 결합력과 THP-1 세포주에서의 anti-proliferative 활성 사이의 높은 상관관계를 보이며, 세포에서 YTHDC1에 결합함을 증명합니다.
Chemically Induced Proximity Approaches for Therapeutic Intervention
Chemical Biology Approaches for a Quantitative Understanding of PPI Stabilization; How to Identify Molecular Glues for the 14-3-3 Interactome (LE029)
PPI
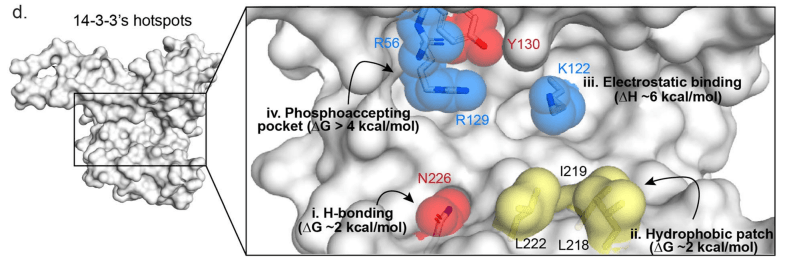
단백질-단백질 상호작용(PPI) 안정화는 단백질 간 상호작용의 안정성을 증가시키는 것으로, molecular glues를 통해서도 이뤄집니다. Molecular glue는 두 단백질 사이에 결합하여 이들을 서로 가까이 가져오는 등 선택적으로 PPI를 조절할 수 있습니다. 잘 알려진 예시로는, CRL4CRBN E3 ubiquitin ligase 복합체에 영향을 미치는 talidomide와 같은 면역조절 이미드 약물(IMiDs)입니다.
14-3-3 단백질은 다양한 신호 단백질과 상호작용한다고 알려져 있는데요, 연사분은 이전에 14-3-3/ChREBP PPI를 선택적으로 안정화하는 molecular glue를 개발하시기도 했습니다. 핫스팟 기능 매핑과 돌연변이 연구를 통해 펩타이드 기반 molecular glue를 개발하여 14-3-3/ChREBP PPI를 선택적으로 안정화했습니다.
Drug discovery Projects
Drug Discovery Beyond the Rule of Five
Identification of TAK-756, a Potent and Selective TAK1 Inhibitor for the Treatment of Osteoarthritis Through Intra-Articular Administration (LE007)
TAK-756
TAK-756은 관절 내 투여를 통한 골관절염 치료를 위해 연구 중인 Transforming Growth Factor-β Activated Kinase 1 (TAK1)의 강력하고 선택적인 억제제입니다. TAK1은 염증 반응을 매개하는 데 중요한 역할을 하며 골관절염을 포함한 다양한 염증성 질환의 잠재적 치료 표적으로 확인되었습니다. 이 약물은 특히 관절 내 투여를 통해 염증과 통증을 완화하는 데 중점을 두고 있습니다. TAK-756은 TAK1을 타깃으로 하여 염증성 사이토카인의 방출을 억제하며, 골관절염의 병리학적 과정을 억제하는 데 효과적입니다. 현재 TAK-756은 전 임상 단계에서 연구되고 있으며, 높은 선택성과 효능을 입증하고 있습니다.
Self-Immolative Pleiotropic Prodrugs: an Innovative way to Treat Alzheimer's Disease? (LE008)
Self-Immolative Pleiotropic Prodrugs
Self-Immolative Pleiotropic Prodrugs(SIPP)는 알츠하이머 치료를 위한 새로운 접근법으로 주목받고 있습니다. 이는 특정 자극에 반응하여 자체적으로 분해되며, 여러 활성 성분을 방출해 다양한 생리적 경로에, 동시에 영향을 미치는 약물입니다. 이는 알츠하이머의 복잡한 병리학적 특성을 고려한 다중 표적 치료제 개발에 유용합니다.
Early Integration of Translational Strategies into Discovery Projects
Translational Biomarker Strategy for Development of MK-4334, a Novel Positive Allosteric Modulator of the α7 nAChR (LE019)
MK-4334
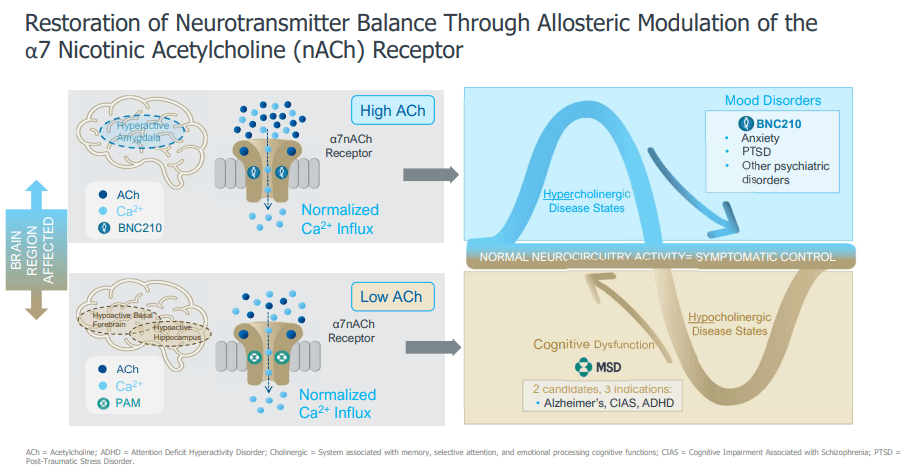
MK-4334는 Bionomics와 MSD의 협력으로 개발된 α7 니코틴성 아세틸콜린 수용체(nAChR) 양성 알로스테릭 조절자(PAM)입니다. PAM은 그 자체로 수용체를 활성화하지 않지만, 수용체의 allosteric site에 결합하여 수용체가 신호 분자에 더 잘 반응하게 만듭니다. 이 약물은 Bionomics의 BNC375로 시작해 개발된 물질로, 현재 임상 1상 진행 중이며 알츠하이머, 정신분열증과 같은 인지 장애 치료에 유망한 후보 물질로 평가되고 있습니다. nAChR 작용제들이 갖고 있는 선택성 부족으로 인한 부작용과 장기 복용 시 약물이 지속적으로 수용체에 결합하면서 수용체의 반응이 점차 줄어드는 현상(receptor desensitization) 등의 문제점을 할 수 있다는 점에서 기존 약물과 차별화됩니다. (NCT03740178, NCT05136690)
Discovery of ASTX295: a Bone-Marrow Sparing MDM2 Antagonist. From Concept to Clinic (LE020)
ASTX295
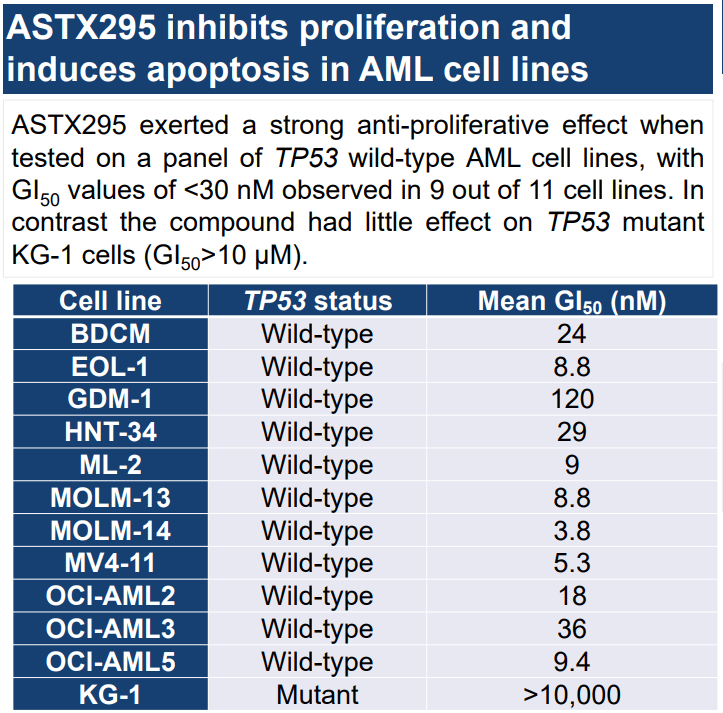
ASTX295는 Astex Pharmaceuticals에서 구조 기반 약물 설계 접근법으로 개발 중인 MDM2 길항제입니다. MDM2를 저해하면 p53 종양 억제 기능이 복원되고, 암세포의 사멸을 유도하는데요, 이 약물은 p53이 정상 wildtype이지만 MDM2가 과발현 된 환자에서 효과가 있었습니다. ASTX295는 짧은 반감기를 가지며, 골수 내 혈액 세포의 생산의 감소를 최소화해 잠재적인 혈소판 감소 위험을 줄여 기존 1세대 MDM2 길항제와의 차별성을 확보합니다. 뿐만 아니라, CYP 대사 및 심장 독성에도 개선된 물성을 보였습니다. 현재 임상 1상을 통과했으며, 2상 진행 예정입니다.(NCT03975387)
rends in Peptide Drug Discovery
From Reversible to Irreversible Peptide Inhibitors of the TRF2TRFH Recruiting Functions: a Strategy to Induce Replication Stress in Cancer Cells (LE034)
TRF2TRFH
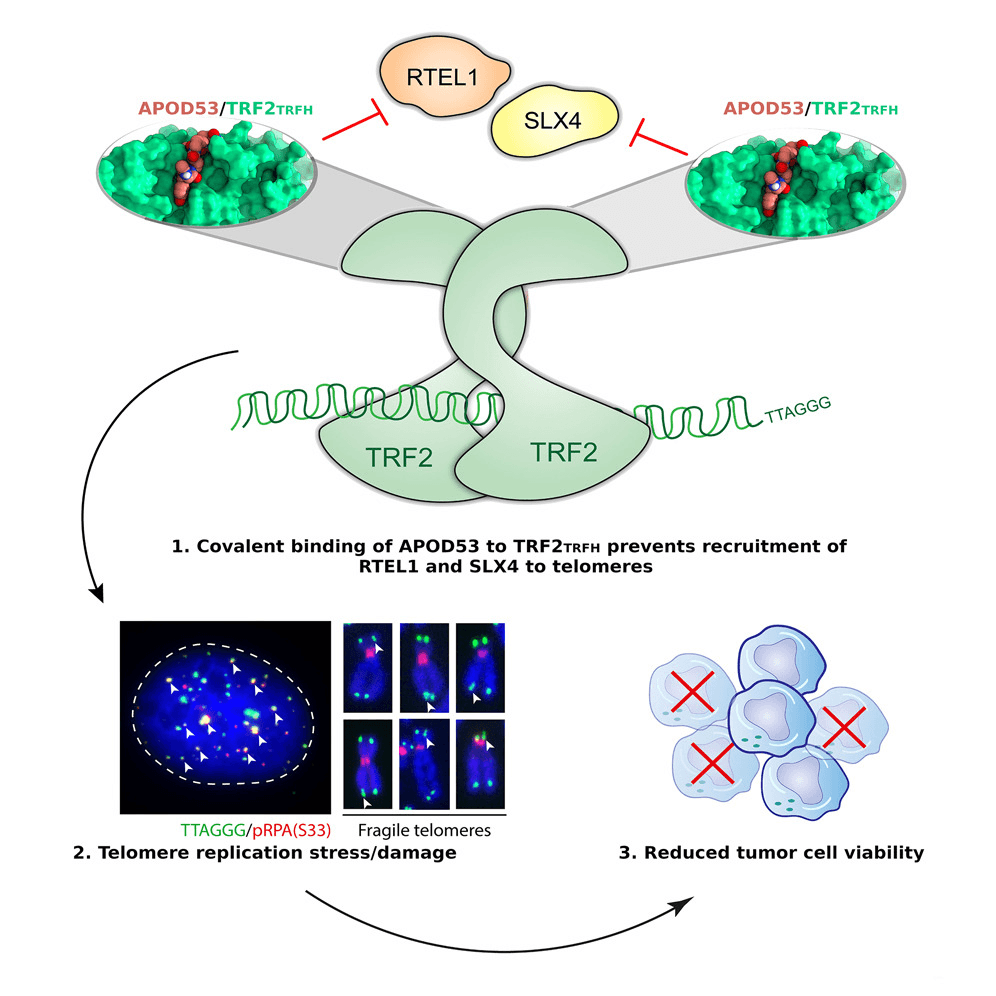
Shelterin을 이루는 여러 단백질 중 하나인 TRF2는 텔로미어 항상성과 게놈 안정성에 필수적인 조절인자입니다. TRF2의 TRFH 도메인은 단백질-단백질 상호작용을 매개하는 영역으로, 다양한 텔로미어 결합 단백질 상호작용을 통해 복합체를 형성합니다. TRF2TRFH 도메인의 돌연변이는 물리적으로 t-loop 형성을 손상하는 등 여러 인자의 모집을 방해하여 텔로미어 DNA 손상을 일으키는 것으로 알려져 있습니다.
따라서, 본 연구진은 TRF2 TRFH 도메인 시스테인에 비가역적으로 결합해 암세포를 사멸하도록 유도하는 공유 고리형 펩타이드를 설계, 합성했습니다. 이로 인해, 텔로미어 DNA 손상 반응 유도, 텔로미어 복제 스트레스 증가, 텔로미어에서 중요한 역할을 하는 두 단백질 RTEL1 및 SLX4 상호작용 방해 등과 같은 현상이 나타납니다. 본 연구진은 APOD53이 암세포 성장을 저해한다는 사실을 실험적으로 입증했습니다. 그뿐만 아니라, G4 안정제 RHPS4와 저용량의 aphidicolin (APH)과 함께 처리했을 때 텔로미어 복제 스트레스를 극대화하며 병용 투여의 장점도 밝혀냈습니다.
Evolution Towards Clinical Candidate MK-0616: Next Generation Oral Tricyclic Peptide PCSK9 Inhibitors for LDL-Lowering and Coronary Heart Diseases (LE035)
PCSK9
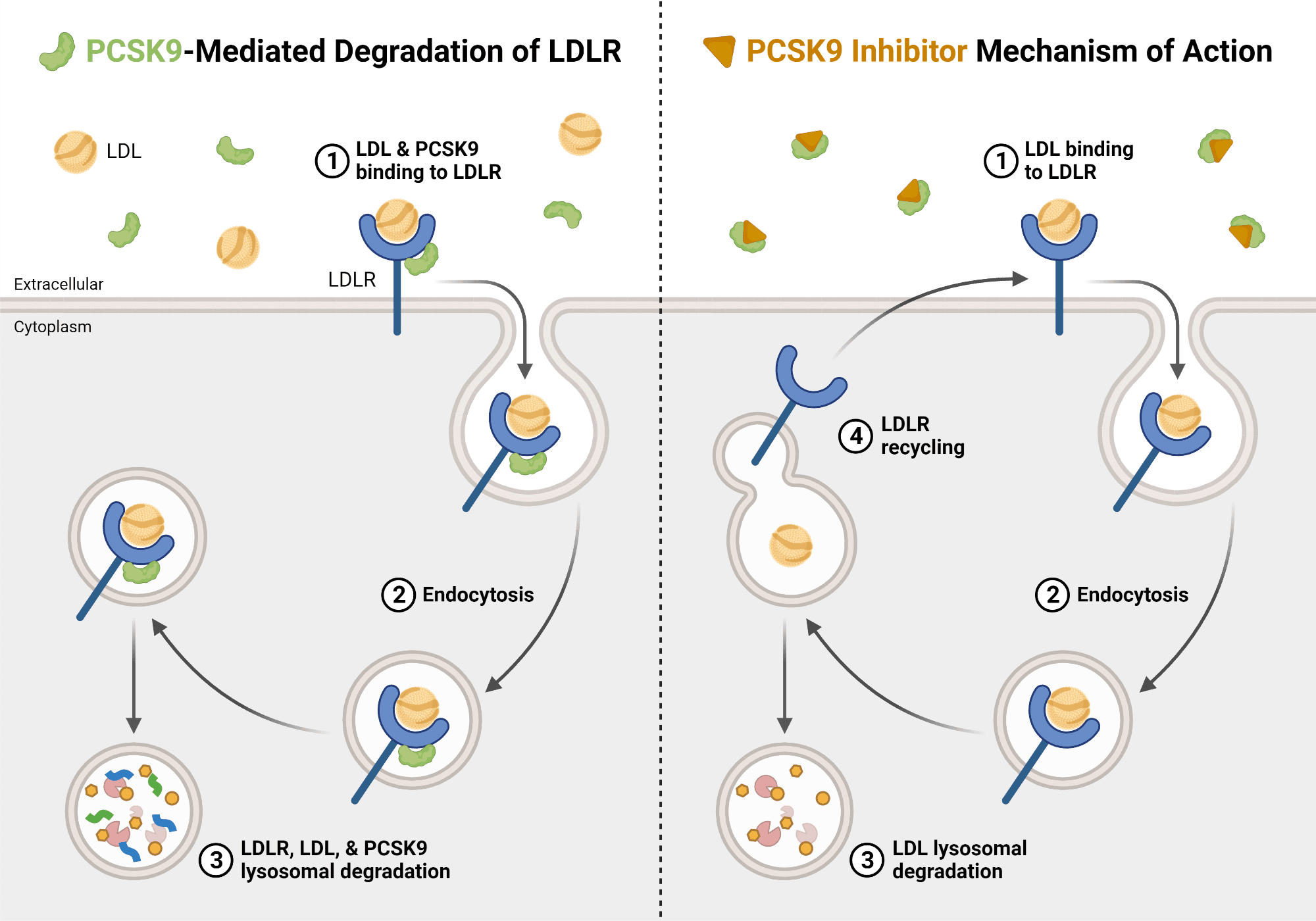
PCSK9는 간에서 생성되는 단백질로, LDL 콜레스테롤 수용체의 분해를 촉진하여 혈액 내 LDL 콜레스테롤 수치를 낮추는 데 중요한 역할을 합니다. PCSK9의 과도한 활성은 고콜레스테롤혈증과 심혈관 질환의 위험을 증가시켜 PCSK9를 억제하는 것은 고콜레스테롤혈증 치료에 중요한 전략으로 떠오르고 있습니다.
연사분은 MK-0616 펩타이드를 통한 PCSK9 저해 연구를 소개해 주실 텐데요, 이는 LDL receptor를 증가시켜서 분해를 촉진합니다. 임상 2b 단계에서 고콜레스테롤혈증 환자들의 LDL-C가 현저히 감소하는 것을 입증했는데요, 이는 경구용 투여로 기존 치료제들은 모두 주사제라는 것에 있어서 차별성을 확보합니다.
Technologies
DNA-Encoded Libraries / ACSMEDI Session
Recent Advances in DNA-Encoded Library Technologies at GSK (LE022)
Using DEL for Targeted Protein Modulation (LE023)
DEL
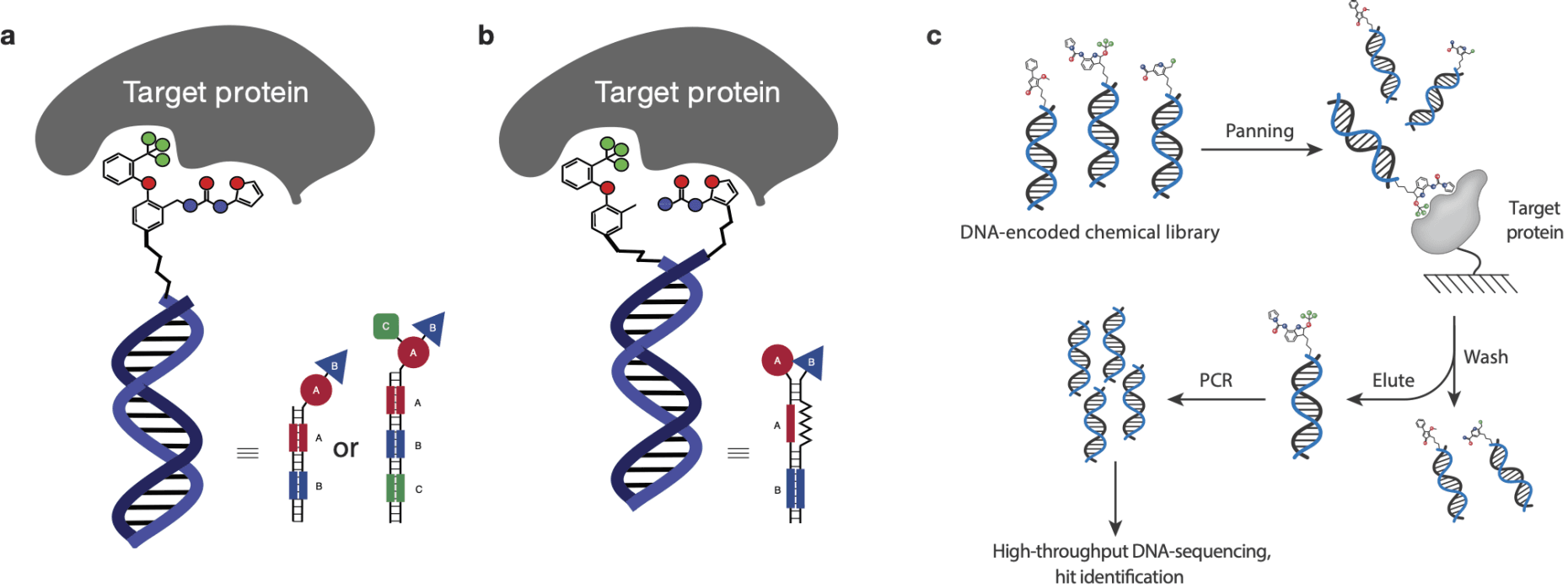
DNA Encoded Library (DEL)는 화합물 라이브러리를 구축하고 고속으로 화합물을 스크리닝 하는 기술입니다. 이 기술은 화합물과 DNA 시퀀싱을 결합하여 다양한 화합물을 효율적으로 탐색하고 약물 후보 물질을 식별하는 데 도움을 줍니다.
각 화합물은 고유한 DNA 바코드와 결합해 있으며, 이를 통해 해당 화합물을 식별하고 추적할 수 있습니다. 이렇게 만들어진 수백만 개의 화합물이 포함된 라이브러리는 표적 단백질과 반응합니다. 결합한 화합물-단백질 복합체는 분리되고, DNA 바코드를 시퀀싱 하여 어떤 화합물이 표적과 결합했는지 확인합니다. 이를 통해 잠재적인 약물 후보 물질을 신속하게 식별할 수 있습니다.
Macrocyclic MCL-1 Inhibitors: an Efficient Combination of DNA-Encoded Library Screening, Parallel
Macrocyclic MCL-1 inhibitors
MCL-1 (Myeloid Cell Leukemia 1)은 BCL-2 단백질 계열에 속하며, apoptosis를 조절하는 중요한 역할을 합니다. 특히, BAX와 BAK 같은 pro-apoptotic 단백질을 억제하여 세포 생존을 촉진합니다. 그러므로 MCL-1의 과발현은 다양한 암, 특히 백혈병, 림프종 및 고형 종양에서 흔히 관찰되며, 이는 암세포의 생존, 화학 요법 저항성에 이바지합니다.
매크로사이클릭 억제제는 큰 고리 모양의 분자 구조를 가지며, 이에 따라 표적 단백질과의 결합 특이성과 효능이 향상될 수 있습니다. 이러한 억제제는 oral bioavailability와 대사 안정성이 개선되는 경우가 많습니다. 매크로사이클릭 억제제는 MCL-1의 BH3 결합 홈에 결합하여 pro-apoptotic 단백질과의 상호작용을 차단합니다. 이로 인해 apoptosis 경로가 활성화되어 MCL-1에 의존하는 암세포가 선택적으로 사멸하게 됩니다.
연사분은 Symeres 회사의 의약화학팀 리더이며, MCL-1 저해제를 DEL 방법론으로 발굴하신 연구 내용에 관해 설명해 주실 예정입니다.
Computational Chemistry and Computational Biology in Drug Discovery
Discovery of HRO761, a First-In-Class Allosteric WRN Inhibitor by Property-Based Design Using AB Initio Conformational Analysis (LE039)
HRO761
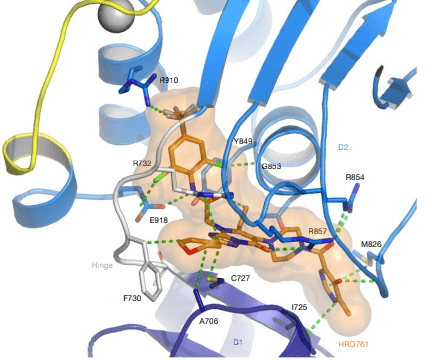
HRO761는 Novartis에서 개발 중인 Werner syndrome RecQ helicase (WRN) 억제제로, 주로 마이크로위성 불안정성(MSI) 암세포를 표적으로 합니다. WRN은 여러 유전자 스크리닝을 통해 MSI 암세포에서 합성치사 타깃으로 확인되었습니다.
HRO761은 이 WRN 단백질을 선택적으로 억제하여 MSI 암세포에서 DNA 손상 및 종양 성장을 억제합니다. HRO761은 WRN 단백질의 D1과 D2 도메인 사이에 결합하여 WRN을 비활성화 상태로 고정합니다. 이를 통해 MSI 암세포에서만 WRN을 분해하고, 마이크로위성 안정성(MSS) 세포에서는 그렇지 않은 선택적인 작용을 보입니다.
이 물질의 개발 과정에서 Property-Based Design과 AB Initio Conformational Analysis가 중요한 역할을 했는데요, 분자의 구조와 에너지를, 양자역학을 사용해 예측하고, 원하는 특성을 갖는 분자를 설계한 방법론입니다. 현재 HRO761의 안전성 등을 평가하는 임상 1상 시험이 진행 중입니다. (NCT05838768)
이상 EFMC-ISMC 2024 세션에 대해 간략히 정리해 드렸습니다. 히츠에서도 EFMC-ISMC 2024에서 전시 부스를 운영하는데요. AI를 통해 세상에 필요한 약을 좀 더 빨리 만들어낼 수 있도록 AI 신약 개발 플랫폼 Hyper Lab을 소개할 예정입니다. 부스 번호 #4에 많은 관심과 응원 부탁드립니다.