하이퍼랩을 활용한 실제 신약 후보 발굴 사례


실제 연구에 활용되는 AI 신약 개발 플랫폼, 하이퍼랩
신약 개발 초기 단계에서 가장 중요한 것은 시간과 정확성입니다. 한정된 시간 안에 원하는 타깃에 맞는 유효 물질을 찾아내는 일은 연구 효율과 직결됩니다. 이 과정에서 AI 신약 개발 플랫폼 하이퍼랩(HyperLab)이 두각을 나타내고 있습니다.
이번 글에서는 하이퍼랩을 활용해 실제 연구에서 유도체를 최적화하고, 유효 물질을 발굴한 두 편의 논문 사례를 소개합니다. 연구진이 하이퍼랩을 통해 어떻게 원하는 결과를 도출했는지 살펴보겠습니다.
하이퍼랩으로 항암제 유도체 최적화, 7MeERT 발굴 사례(Biomolecules)
이 연구는 뇌종양, EGFR 과발현, 다발성 골수종 등 다양한 암세포에 효과적인 신규 항암제를 개발하는 것을 목표로 했습니다. 타깃 단백질은 NDUFA12이며, 기존 약물 Ertredin은 이 단백질과 상호작용하지만 일부 암세포에서는 항암 활성이 제한적인 한계가 있었습니다.
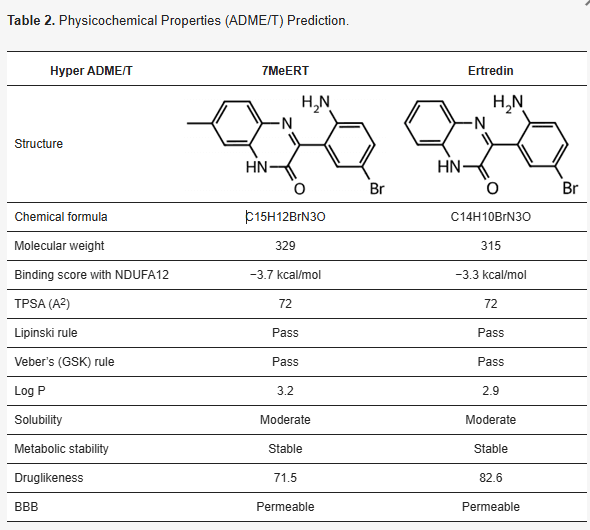
이를 해결하기 위해 연구팀은 하이퍼랩을 활용하여 분자 도킹과 AI 기반 하이브리드 가상 탐색을 수행했습니다. 그 결과, 기존 Ertredin에 메틸기를 도입한 새로운 유도체인 7MeERT가 NDUFA12와 결합력이 더 우수할 것이라 예측할 수 있었습니다. 또한 하이퍼랩의 ADME/T 예측 기능, 구조-활성 관계 분석 기능을 통해 약물 가능성과 최적화 방향도 검토했습니다.
실험 결과, 7MeERT는 Ertredin보다 낮은 결합 에너지(−3.7 vs. −3.3 kcal/mol, 음수 값이 낮을수록 결합력이 강함)를 보여 더 강한 결합력을 나타냈으며, 항증식 효과와 아폽토시스 유도 능력도 우수했습니다.
이는 하이퍼랩의 AI 예측값을 통해 후보 물질을 조기에 선별하게 되면서, 신약 개발에 드는 비용과 시간을 절감한 실제 사례입니다.
출처 : Biomolecules 2024 논문 (https://www.mdpi.com/2218-273X/14/9/1197)
하이퍼랩으로 LATS 저해제 설계, AI 분석의 실험적 검증 사례(RSC Medicinal Chemistry)
작년에 발표된 논문 “Discovery of selective LATS inhibitors via scaffold hopping”는 하이퍼랩의 하이퍼 바인딩 기능을 실제 연구에 성공적으로 적용한 사례입니다. 본 연구에서는 하이퍼랩의 하이퍼 바인딩 기능을 이용해 타겟 단백질에 대해 높은 활성을 보이는 후보물질을 도출했습니다.
연구팀은 먼저, 알려진 기준(reference) 화합물인 ’Truli’의 결합 구조를 바탕으로 단백질-리간드 간의 핵심 상호작용(key interaction)을 분석하였습니다. 이후, 하이퍼랩의 하이퍼 바인딩 기능을 활용해 신규 분자의 결합 구조및 결합력을 예측하고, 기존 핵심 상호작용이 유지 되는지를 평가하였습니다.
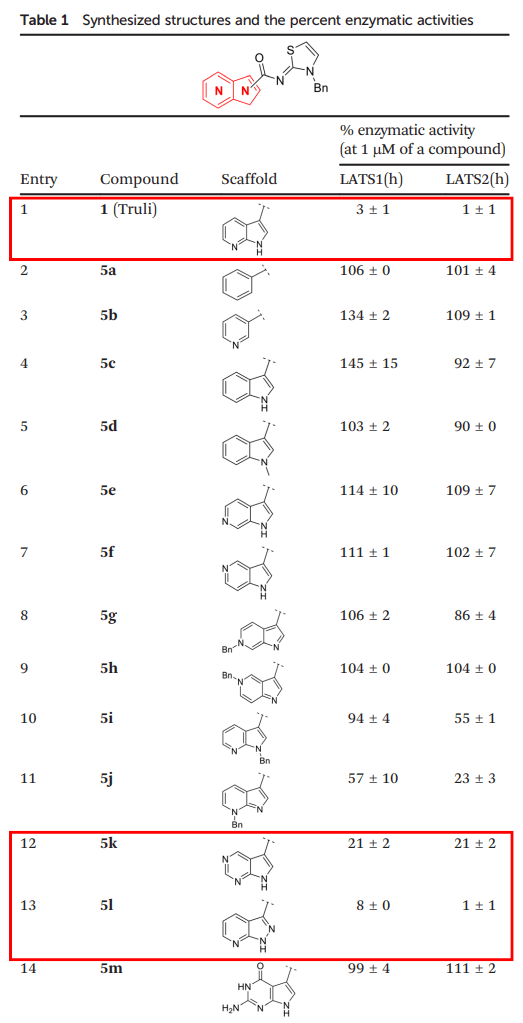
그 결과, 바인딩 점수가 우수하고 핵심 상호작용을 유지한 후보물질 5k와 5l이 도출되었습니다. 또한 하이퍼랩의 2D 및 3D 구조 뷰어 기능을 통해, 154번 Met와 156번 Glu가 리간드와 수소 결합을 형성하는 구조에 있어서, 기준 화합물과 동일하게 유지되고 있다는 걸 확인할 수 있었습니다.
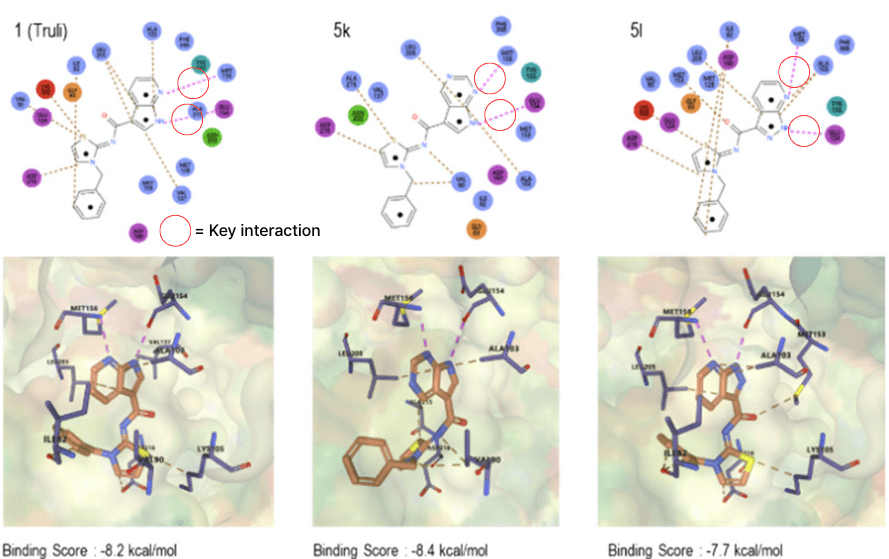
결론적으로, 하이퍼랩을 통해 활성이 높을 것으로 예측된 후보물질들은 실험에서도 우수한 활성을 나타냈습니다. 이는 결합 에너지와 결합 구조를 함께 고려할 경우, 하이퍼 바인딩 기반 분석의 성공 확률을 크게 높일 수 있음을 입증한 사례입니다.
출처: ResearchGate 2024 논문 ("Discovery of selective LATS inhibitors via scaffold hopping")
하이퍼랩의 AI로 앞당기는 신약 개발의 가능성
지금까지 하이퍼랩의 하이퍼 바인딩 기능과 하이퍼 ADME/T 기능이 실제 연구에 어떻게 활용되었는지 두 편의 논문으로 살펴보았습니다. 타깃 단백질과 분자 간 결합력 예측, 2D 및 3D 뷰어를 통한 결합 구조 화면 분석, 이 외에도 신약 개발 초기 단계에서 활용할 수 있는 다양한 기능이 하이퍼랩 안에 탑재되어 있습니다.
- 100만 개 분자 중 타깃 단백질과 결합력이 높은 상위 500개 분자를 하루 만에 선별하는 하이퍼 스크리닝
- 11조 개 이상의 화합물 중 합성 가능성이 높은 유효 물질을 최대 48시간 만에 선별하는 하이퍼 스크리닝 X
- 신규성과 활성을 동시 충족하기 위해 AI로 분자 구조를 개선하는 하이퍼 디자인
이뿐만 아니라 하이퍼랩은 직관적인 UI/UX로 누구나 쉽게 사용할 수 있습니다. 하지만 처음 사용하는 분들은 설정이나 분석 방식에서 어려움을 느낄 수 있습니다. 이를 돕기 위한 수단으로 무료 컨설팅을 제공하고 있으니, 신약 개발 과정에서 AI를 도입하고자 하는 분들은 아래 도입 문의를 통해 상담을 받아 보시길 권해드립니다. 실제 논문을 통해 검증된 만큼, 하이퍼랩이 신약 개발의 효율성과 정확도를 높이는 데 실질적인 도움이 되리라 자신합니다.
AI 신약개발 플랫폼 하이퍼랩
- 무료체험 https://buly.kr/NkDHC3
- 도입문의 https://abit.ly/yyytsg