신약 개발 승인 현황 모음 - 국내 및 FDA 신약 승인 현황 모아 보기


지난 포스팅에서는 신약개발 과정에서 의약 화학의 역할, 이해, 적용 사례에 대해 살펴보았습니다. 이번 글에서는 신약개발 관련 국내 / 해외 FDA 승인 현황을 살펴보며 신약개발의 과거와 현재를 돌아보도록 하겠습니다.
신약개발 승인 현황(국내)
과거 신약개발 승인 현황
우리나라 제약사들의 신약 개발은 1987년 물질특허제도 도입을 시발점으로 시작되었습니다. 1990년대 후반부터는 정부사업이 본격화되며 신약 개발 사업이 추진되었는데요. 1999년 국내 신약 1호 위암 치료제인 ‘산플라주’가 탄생하였습니다. 2003년에는 국내 신약 최초로 항생제 ‘팩티브’가 미국 FDA 승인을 받으며, 이로써 대한민국은 세계에서 10번째로 신약 개발에 성공한 국가가 되었습니다.
2023년 기준, 국내에서 36개의 신약이 승인되었습니다.
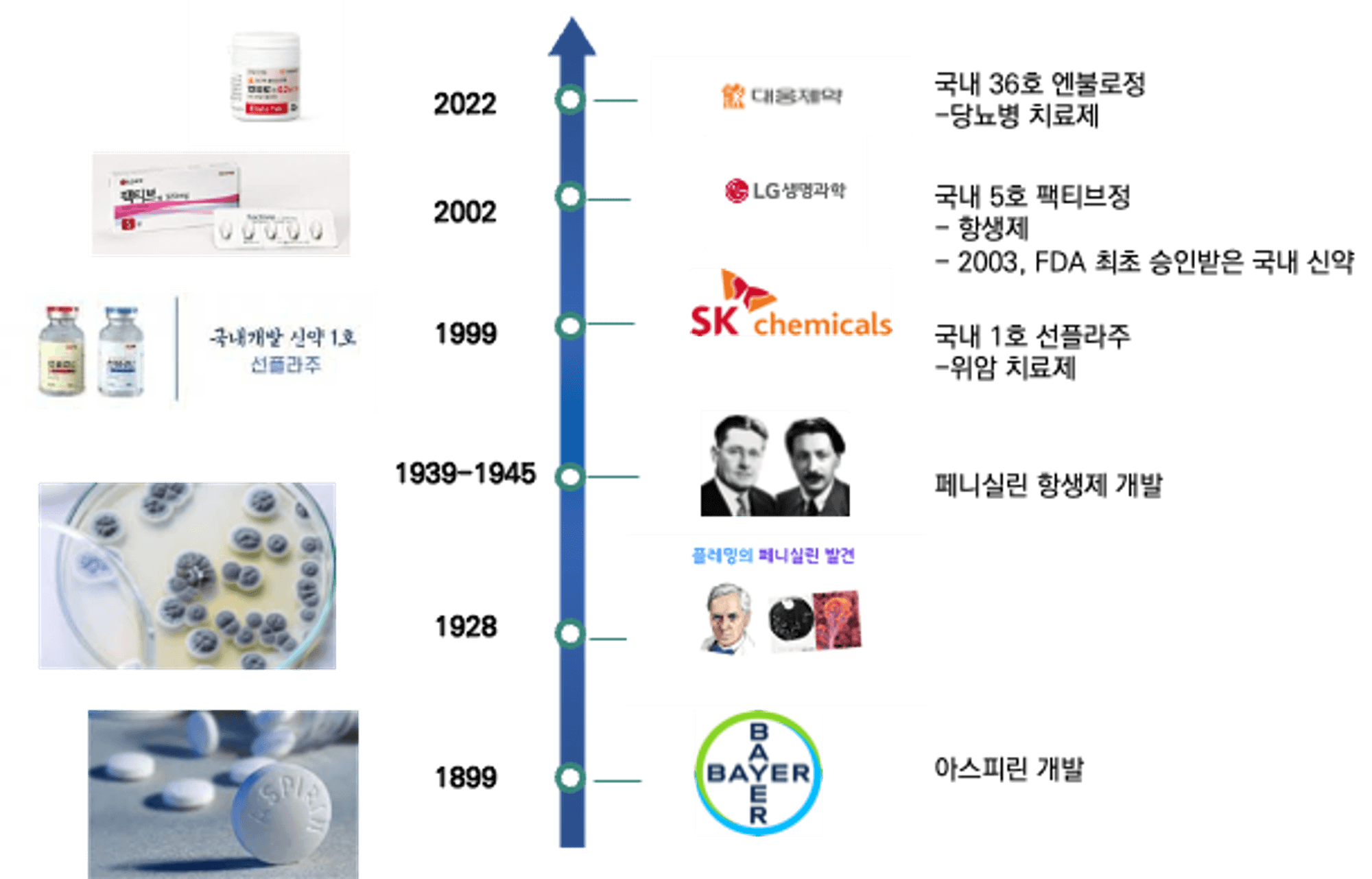
현재까지의 신약개발 승인 현황
그렇다면 지금 현재 시점의 신약 개발 현황은 어떠할까요? 한국신약개발연구조합 사이트에서는 국내 신약개발 현황 정보를 제공하고 있습니다.
한국신약개발연구조합 사이트 접속 → “국내 R&D 동향” → “신약 개발 현황” 페이지를 통해 아래와 같은 국내 신약 승인 정보를 확인하실 수 있습니다.
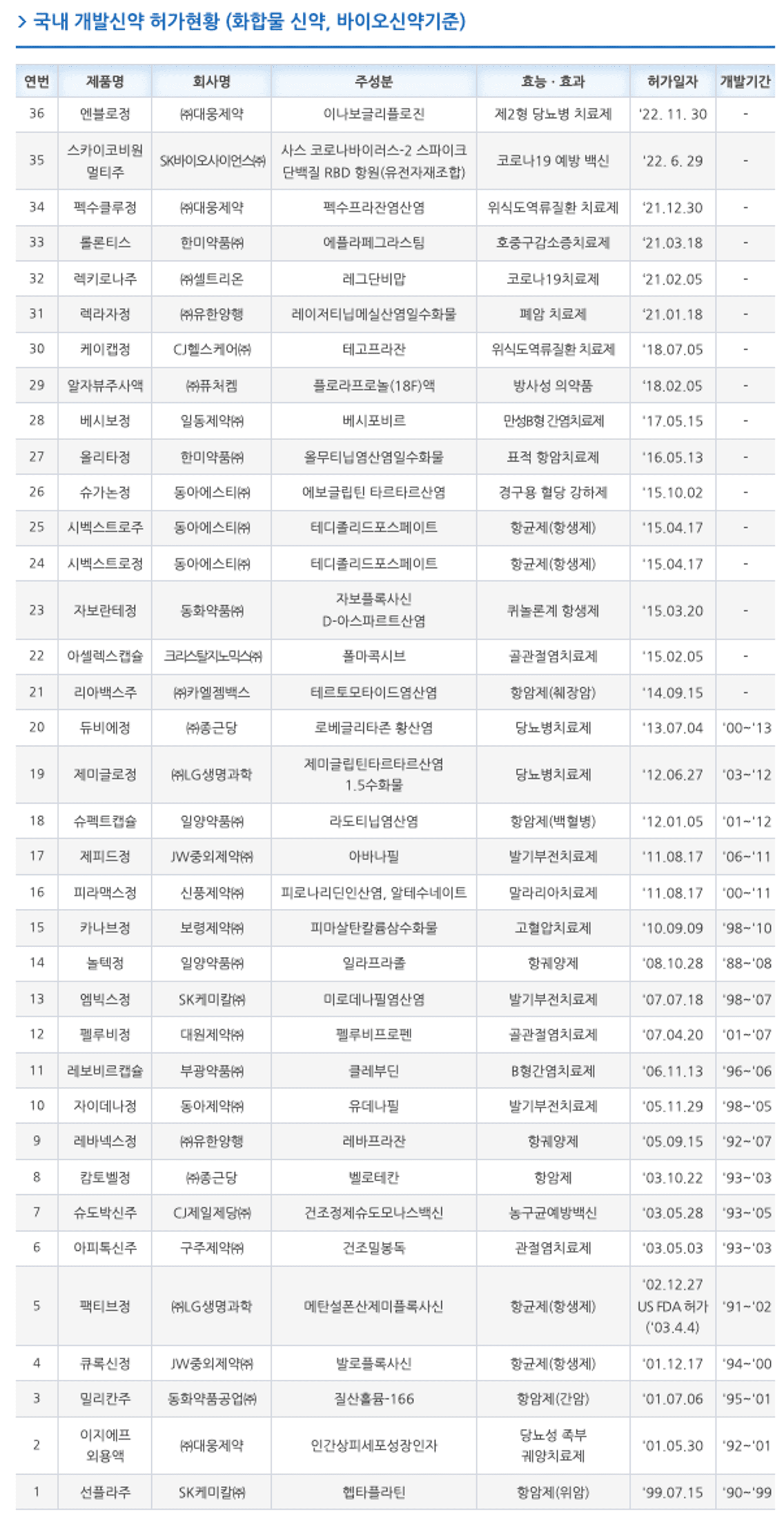
(참고자료 : 한국신약개발연구조합 )
사실 신약 시장은 국내보다 해외 시장 규모가 훨씬 큽니다. 해외 시장을 가기 위해서는 미국 FDA 승인 절차가 필수 수반돼야 하는데요. 그렇다면 이제 미국 FDA 신약 승인 현황을 한번 살펴볼까요?
신약개발 승인 현황 (FDA)
FDA 신약개발 과거 승인 현황
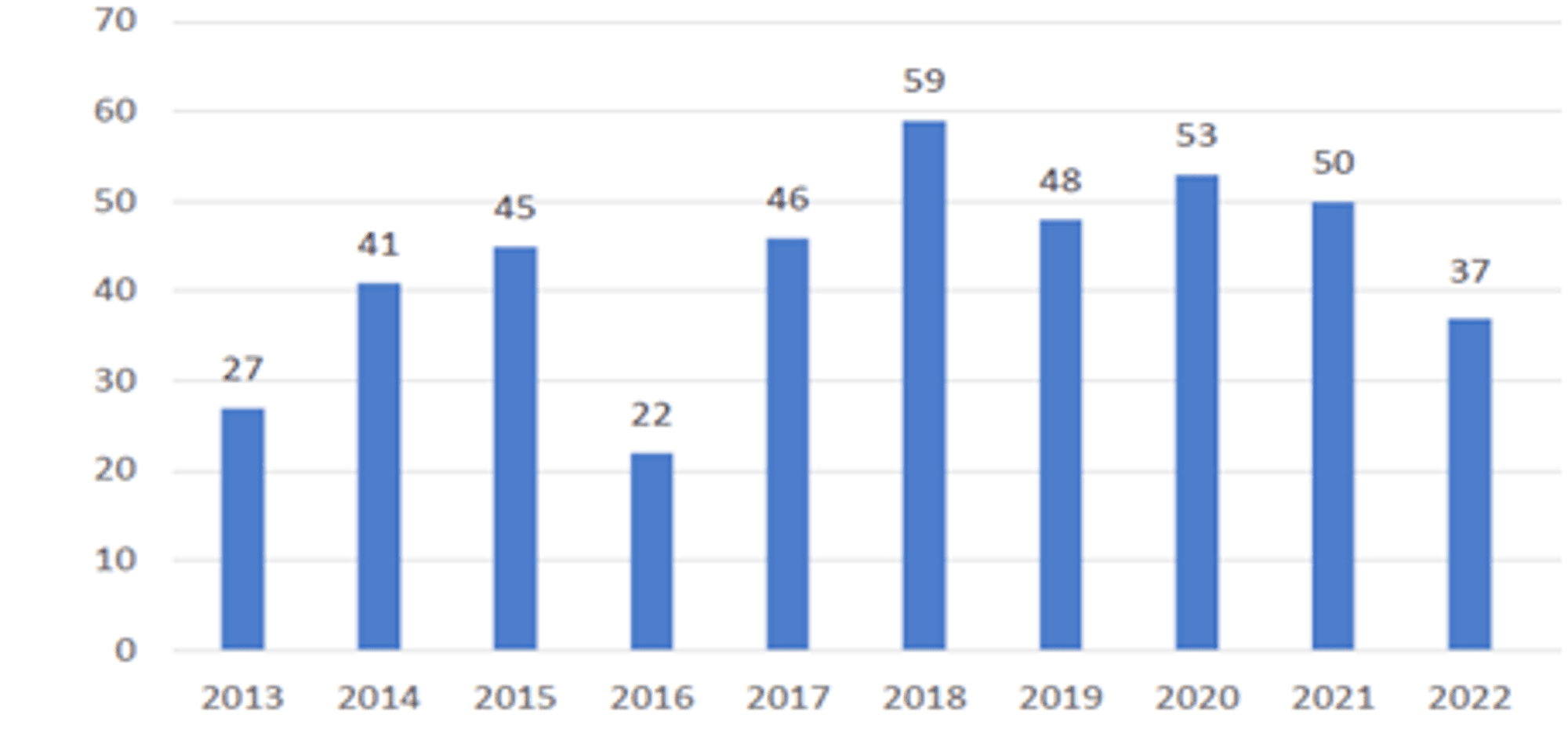
전 세계 신약 개발 연구원의 노력 덕분에 매년 신약 개발이 이루어지고, 신규 의약품으로 승인되고 있습니다. 아래 그래프를 통해 2013년부터 2022년까지 약 9년간의 FDA 신약개발 승인 현황을 볼 수 있는데요.
2022년에는 37개의 신약 승인이 이루어지며, 2016년 이후 최저치를 기록하였습니다.
9년간 승인된 신약 중 합성의약품과 바이오의약품의 비중을 테이블 단위로 살펴보면 다음과 같습니다.
신약 안에서 합성의약품(여러 화학 물질을 적절히 배합해 인공적으로 만드는 약물)과 바이오 의약품(살아있는 세포를 배양해 만드는 약물)의 차이에 대해 알고 싶으시다면 지난 포스팅 신약 개발 과정에서 의약 화학의 역할, 이해, 적용 을 참고해주세요.
| 구분 | 2013년 | 2014년 | 2015년 | 2016년 | 2017년 | 2018년 | 2019년 | 2020년 | 2021년 | 2022년 |
| 합성의약품 | 25개 | 30개 | 33개 | 15개 | 34개 | 42개 | 38개 | 40개 | 36개 | 22개 |
| 바이오의약품 | 23개 | 11개 | 12개 | 7개 | 12개 | 17개 | 10개 | 13개 | 14개 | 15개 |
| 합계 | 27개 | 41개 | 45개 | 22개 | 46개 | 59개 | 48개 | 53개 | 50개 | 37개 |
출처 : FDA, Advancing Health Through Innovation: New Drug Therapy Approvals 2022, 2023,1.10.
FDA 신약개발 승인 현황(2023년)
2023년 상반기, FDA에서는 30건의 신약을 승인하였습니다.
이들 의약품을 모달리티(약물이 표적을 타깃하거나 약효를 나타내는 방식) 기준으로 분류했을 때, 합성의약품 (Small Molecule)이 18건으로 60%, 바이오의약품이 11건으로 37%를 차지하고 있습니다. 그외 유전자 치료(Gene Therapy)가 1건 승인되었습니다.
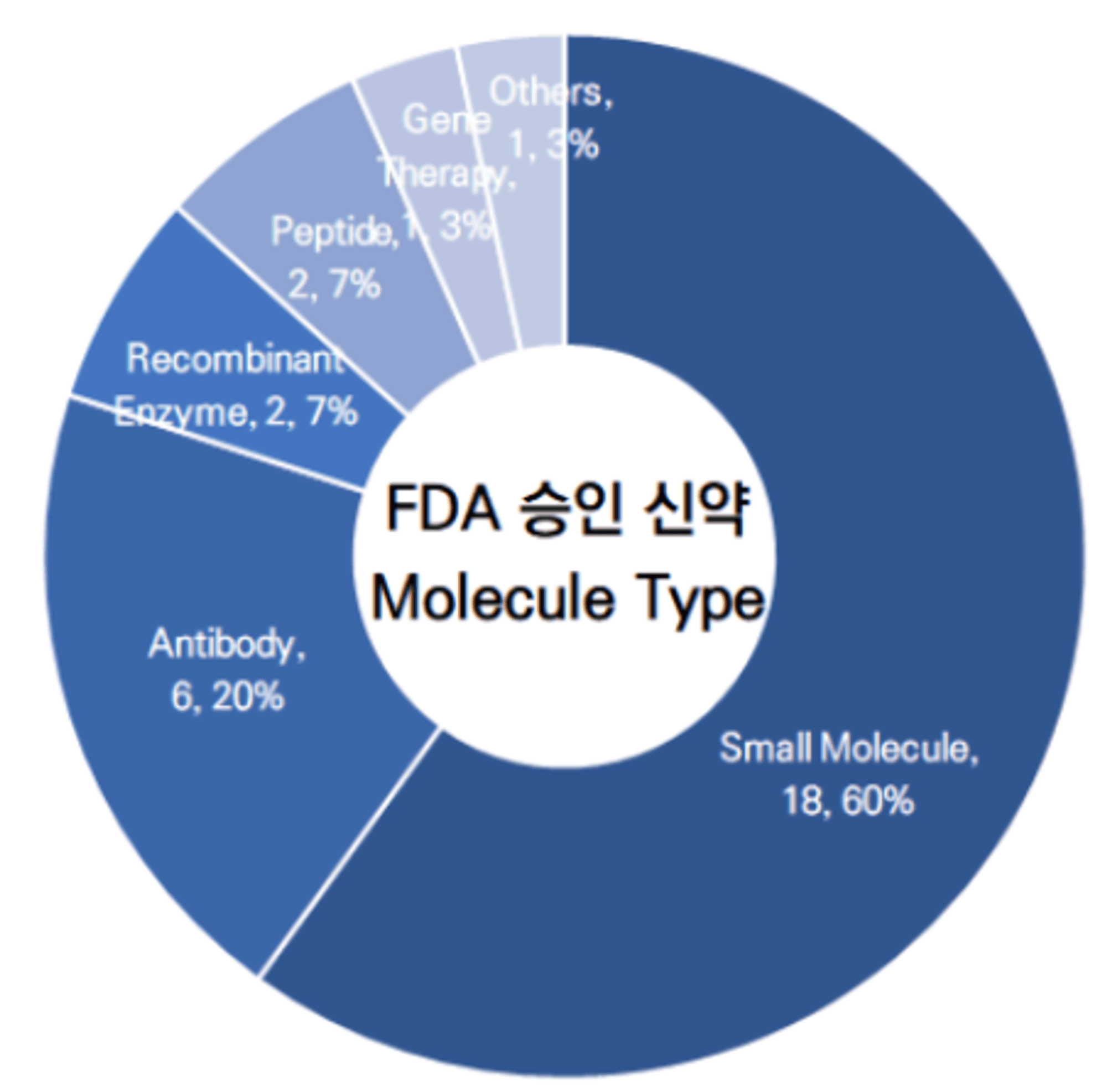
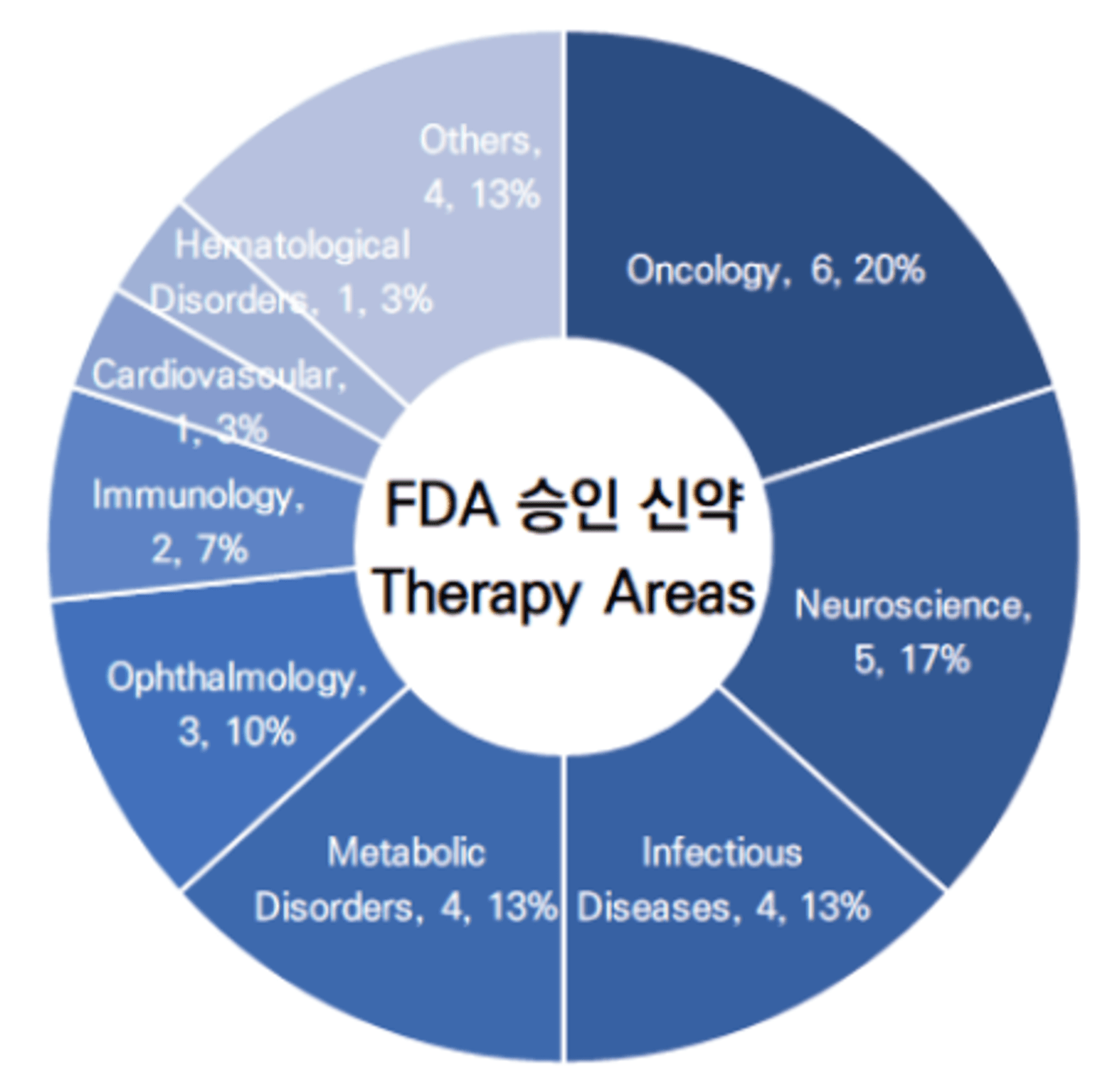
참고자료 : Novel Drug Approvals for 2023
이번 해에 특히 주목할 점은 7개의 의약품이 신약개발 가속 승인 경로에 따라 승인됐다는 점입니다. 또한 다수의 약물이 최초 치료제로 승인된 점도 눈에 띄는 기록입니다. 최초로 승인된 치료제를 구체적으로 알아보면 다음과 같습니다.
스카이클라리스 Skyclarys (2023년 2월 FDA 승인)
Reata의 NRF2 활성제인 Skyclarys(성분명: omaveloxolone)는 퇴행성 신경근 장애인 프리드리히 운동실조증(Friedreich's ataxia)을 치료하는 최초의 치료제가 되었습니다.
스카이클라리스 FDA 신약 승인 관련 기사 - "美 FDA, 첫 프리드라이히 운동실조 치료제 승인", 의약 뉴스, 2023.03.02
데이뷰 Daybue (2023년 10월 FDA 승인)
거의 여아에게만 영향을 미치는 희귀 신경 장애인 레트 증후군도 Acadia Pharmaceuticals의 IGF1 조절제인 Daybue(성분명: Trofinetide)가 승인되면서 치료 옵션을 갖게 되었습니다.
FDA 신약 승인 관련 기사 : "美 아카디아파마슈티컬스 ‘데이뷰’ 레트증후군 FDA 최초 치료제로 승인", 헬스오, 2023.03.11
오르세르두 Orserdu (2023년 1월 FDA 승인)
Menarini의 전이성 ER, HER2-, ESR1 변이 유방암 치료제 Orserdu(성분명: elacestrant)는 최초의 경구용 선택적 에스트로겐 수용체 분해제가 되었습니다.
FDA 신약 승인 관련 기사 : "美 FDA, 메나리니 경구 SERD 유방암 치료제로 승인", 의약뉴스, 2023.01.31
람제드 Lamzede (2023년 2월 FDA 승인)
Chiesi Farmaceutici의 Lamzede(성분명: velmanase alfa)는 매우 희귀한 리소좀 축적 질환인 알파 만노시도증의 최초 치료제로서 FDA 승인을 획득하였습니다.
FDA 신약 승인 관련 기사 : "극희귀 만노사이드축적증 치료제 '람제드' FDA 승인", The Voice, 2023.02.20
조엔자 Joenja (2023년 3월 FDA 승인)
Pharming의 Joenja(성분명: leniolisib)는 극희귀 자가면역질환인 활성화된 PI3K Delta 증후군 환자를 위한 최초의 치료제로 승인받았습니다. 활성화된 PI3K Delta 증후군은 미국에서 확인된 환자가 200명에 불과하며, 반복적인 호흡기 감염과 면역조절장애를 특징으로 합니다.
FDA 신약 승인 관련 기사 : "超희귀질환 APDS 치료제 ‘조엔자’ FDA 승인", 약업신문, 2023.03.27
이외에도 2023년 하반기에는 아래와 같은 신약이 FDA 승인 절차를 진행하고 있습니다.
일라이 릴리의 도나네맙(Donanemab, Aβ mAb/알츠하이머)
FDA 신약 승인 관련 기사 : "치매 정복 길 열리나…릴리 신약 '도나네맙', 초기 진행 늦춰", 청년의사, 2023.07.18
MSD 의 소타터셉트(Sotatercept, ACVR2A-Fc antagonist/폐동맥 고혈압)
FDA 신약 승인 관련 기사 : "MSD, 폐동맥 고혈압치료제 소타터셉트 FDA 신청 수락", The Voice, 2023.10.04
이처럼 희귀 질환 연구 성과들이 하나둘씩 승인받기 시작하며, 앞으로는 미충족 치료영역에 대한 필요가 점차 줄어들 것으로 예상됩니다.
(참고 자료 : 신약개발 사업과 동향에 대한 참고사이트, 국가신약개발재단 )
마무리
지금까지 국내, FDA 신약개발 승인 현황을 살펴보았습니다. 다음 시간에는 신약개발 과정을 가속화하는 AI 기술에 대해 살펴보도록 하겠습니다.
하나의 신약이 만들어지기까지는 평균 기간 15년, 비용은 2-3조원에 달할 정도로 막대한 개발 비용과 시간이 소요됩니다. 세상에 필요한 새로운 약이 더 빨리 탄생하기 위해, 제약 업계의 디지털 전환이 연일 화두가 되고 있습니다.
관련 내용이 궁금하시다면 아래 포스팅을 참고해 주세요.