2024년 신약개발 모달리티 트렌드는 이거야!


ADC를 이을 차세대 혁신 신약은 TPD (Target protein degraders)!
(*모달리티(Modality)는 의약품이 표적을 타깃 하는 방법 또는 약물이 약효를 나타내는 방식입니다.)
지난 포스팅 글로벌 제약 회사 M&A 순위를 다루며 2023년에는 ADC 분야에서 가장 큰 거래가 성사되며 제약 시장이 새로운 모달리티를 필요로 하고 있다는 점으로 마무리했었죠. 오늘은 그 새로운 기대주를 소개해드리겠습니다.
올해 들어 글로벌 제약사, 특히 당뇨·비만 치료제 ‘위고비’와 희귀 혈액질환 분야에서 세계적인 제약사로 꼽히는 노보노디스크와 일라이릴리가 표적 단백질 분해(TPD) 의약품 분야에 적극 투자하고 있다는 소식이 전해졌습니다.
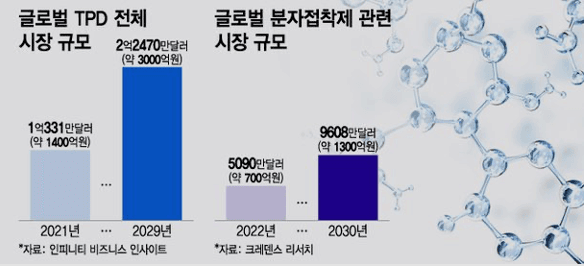
노보노디스크는 TPD 분야에서 특히 단백질 간 결합을 유도하는 분자접착제 플랫폼을 바탕으로 연구 중인 네오모프와 약 2조 원 규모의 공동 연구개발 및 라이선스 계약을 체결했습니다.
또한 일라이릴리는 TPD 관련 플랫폼 개발사의 자금 조달에 참여하며, 빅파마들이 본격적으로 시장에 진입하는 움직임을 보이고 있습니다. 이에 발맞춰 국내 기업인 대웅제약, 일동제약, SK바이오팜 등도 분자접착제 기반 TPD 신약 연구에 적극적으로 나서고 있습니다.
* 분자접착제(Molecular glue): 약물 개발이 어려운(undruggable) 타깃에 대한 신약 개발 가능성을 높이기 위한 방식으로, TPD 기술의 핵심적인 모달리티 중 하나로 평가받고 있습니다.
물론 국내에서도, 최근 오름테라퓨틱이 TPD와 ADC를 결합한 'TPD2'(이중 정밀 표적 단백질 분해제) 기술로 미국 BMS에 기술이전을 성사시키며 빅딜을 이루어낸 사례도 있습니다.
글로벌 기업들의 TPD에 대한 관심이 높아짐에 따라, 이 분야는 향후 더욱 빠르게 성장할 시장으로 전망되고 있습니다.
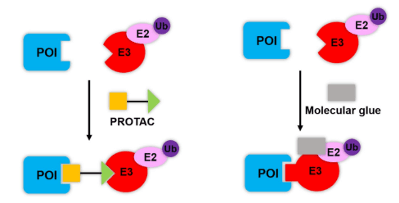
TPD란 무엇일까?
TPD(Target Protein Degradation)는 질병을 일으키는 원인이 되는 표적 단백질을 분해해 제거하는 약물이며, 표적 단백질에 결합해 기능을 억제하는 기존 표적 치료제에 비해 치료 효과가 더 뚜렷한 것으로 알려져 있습니다.
질병을 유발하는 단백질의 기능을 억제하는 차원이 아니라, 아예 없애버리기 때문에 보다 근본적인 치료가 가능하다는 장점이 있습니다.
분자접착제(Molecular glue)란 원래 상호작용하지 않던 단백질들이 서로 가까이 붙을 수 있게 도와주는 약물입니다.
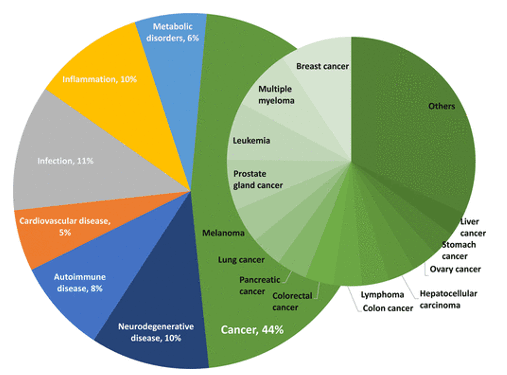
난치성 질환 치료에 효과적인 TPD 신약에 대한 주목도도 함께 높아지고 있으며, 분자접착제 기술을 활용하는 기업들도 점점 늘어나고 있어요. 현재 대부분의 연구는 암을 적응증으로 진행 중이지만, 향후 신경계 질환 등으로 적응증이 확대될 가능성도 높은 것으로 보입니다.
(아래 그림 참고)
잠깐 상식! Thalidomide 이야기
잠시 쉬어가는 코너로, Molecular glue로 잘 알려진 Thalidomide의 역사에 대해 살펴보겠습니다. 사실 Thalidomide는 1950년대에 임산부의 입덧을 완화하는 약으로 개발되어 사용됐지만, 태아의 사지 발달을 저해해 수많은 기형아를 유발한 약물입니다.
이로 인해 1960년대 초 결국 시장에서 퇴출됐죠. 그런데 이후 다발성 골수종(multiple myeloma)에 탁월한 효과가 있는 것으로 밝혀지면서 제한적으로 다시 연구되기 시작했습니다. 2010년, 일본 연구팀이 Thalidomide가 CRL4 E3 ligase complex의 substrate receptor인 CRBN에 결합할 수 있다는 사실을 밝혀냈고, 이후 Thalidomide 계열 약물이 CRBN에 결합하면서 IKZF1/3과 같은 단백질과의 결합을 유도해 표적 단백질의 분해를 촉진할 수 있다는 작용 메커니즘이 제시됐습니다.
이렇게 해서 Thalidomide는 새로운 적응증과 모달리티로 다시 주목받게 되었습니다.
다시 본론으로 돌아가, 지난 5월에 열린 2024년 바이오 코리아에서도 '뉴 모달리티 개발 전략'이라는 스페셜 세션이 마련되어, 국내외 신약 및 모달리티 개발 기업들이 자사 기술을 소개하고 타 기업과의 협력을 모색하는 자리가 열리기도 했습니다. 이제 ‘새로운 모달리티’는 신약 개발에 있어 필수적인 요소가 되었습니다.
질병마다, 그리고 환자 개인마다 서로 다른 특성이 존재하는 만큼 약물의 효과를 높이기 위해서는 다양한 모달리티에 대한 연구는 앞으로 더욱 가속화될 것으로 보입니다. 현재 개발 중인 TPD 현황3을 정리하면서 포스팅을 마무리할게요.
TPD 개발 현황³
| Company | PROTAC | Target | Indication | E3 ligase | Clinical phase |
|---|---|---|---|---|---|
| Arvinas | ARV-110 | AR | 전립선암 | CRBN | Phase II |
| ARV-471 | ER | 유방암 | Phase II | ||
| ARV-766 | AR | 전립선암 | 미공개 | Phase I | |
| Bristol Myers Squibb | CC-94676 | AR | 전립선암 | CRBN | Phase I |
| Dialectic Therapeutics | DT2216 | BCL-xL | 혈액암, 고형암 | VHL | Phase I |
| Foghorn Therapeutics | FHD-609 | BRD9 | 활막육종 | 미공개 | Phase I |
| Kymera | KT-413 | IRAK4 | 거대 B세포 림프종 | CRBN | Phase I |
| KT-333 | STAT3 | 혈액암, 고형암 | 미공개 | Phase I | |
| KT-474 | IRAK4 | 자가 면역 질환 | 미공개 | Phase I | |
| Nurix Therapeutics | NX-2127 | BTK | B세포 림프종 | CRBN | Phase I |
| NX-5948 | BTK | B세포 림프종, 자가 면역 질환 | CRBN | Phase I | |
| C4 Therapeutics | CFT8634 | BRD9 | 활막육종 | CRBN | IND |
AD, atopic dermatitis; AR, androgen receptor; BCL-xL, B cell lymphoma-extra large; BRD9, bromodomain-containing protein 9; BTK, Bruton’s tyrosine kinase; CRBN, cereblon; EGFR, epidermal growth factor receptor; ER, oestrogen receptor; HS, hidradenitis suppurativa; IND-e, in IND-enabling preclinical studies; IRAK4, interleukin-1 receptor-associated kinase 4; i.v., intravenous; PROTAC, proteolysis-targeting chimera; RA, rheumatoid arthritis; ROA, route of administration; STAT3, signal transducer and activator of transcription 3; TRK, tropomyosin receptor kinase; VHL, von Hippel–Lindau.
| Company | Molecular glue | Target | Indication | E3 ligase | Clinical phase |
|---|---|---|---|---|---|
| Bristol Myers Squibb | CC-220 | IKZF1/3 | 다발성 골수종 | CRBN | Phase II |
| CC-92480 | IKZF1/3 | 다발성 골수종 | CRBN | Phase II | |
| CC-90009 | GSPT1 | 급성 골수성 백혈병 | CRBN | Phase II | |
| CC-99282 | IKZF1/3 | 급성 골수성 백혈병, 비호지킨 림프종 | CRBN | Phase I | |
| C4 Therapeutics | CFT7455 | IKZF1/3 | 다발성 골수종 | CRBN | Phase I |
| Novartis | DKY709 | Helios | 비소세포폐암 | CRBN | Phase I |
CRBN, cereblon; GSPT1, G1 to S phase transition 1; IKZF1, IKAROS family zinc finger 1; MM, multiple myeloma; NSCLC, non-small-cell lung carcinoma.
ref.
1. Molecular Diversity 2024, 28, 309–333
2. Biochemistry 2023, 62, 601−623
3. Nat Rev Drug Discov. 2022, 21(3), 181-200