신약개발
2025년 1월 FDA 승인 조회 – 최신 신약 목록
2025년 1월, FDA(미국 식품의약국)은 다양한 질환을 대상으로 새로운 치료제 승인을 발표했습니다. 1월 신약 승인 목록과 작용 기전을 확인해 보겠습니다.
히츠 하이퍼랩 팀
2025.02.067min read

FDA 승인 신약 확인: 최신 치료 옵션
2025년 1월, FDA(미국 식품의약국)는 다양한 질환을 대상으로 새로운 치료제 승인을 발표했습니다. 이번에 FDA에서 승인한 신약들은 통증 관리, 암 치료, 진통제, 급성 편두통 발작 완화 등에서 획기적인 치료 옵션을 제공합니다. 아래에서 FDA 승인 조회를 통해 2025년 1월 신약 승인 목록과 작용 기전을 확인해 보겠습니다.
2025년 1월 FDA 승인 목록 – FDA 승인 확인
| 신약 이름 | 적응증 | 모달리티 | 타겟 단백질 | 개발사 | 승인 날짜 |
|---|---|---|---|---|---|
| Lumakras + Vectibix combination | KRAS 변이 전이성 대장암 | small molecule, antibody | KRAS G12C, EGFR | Amgen | 1월 17일 |
| Datroway | HR+/HER2- 전이성 유방암 | ADC | TROP2 | AstraZeneca, Daiichi Sankyo | 1월 17일 |
| Journavx | 수술 및 부상 후 단기 통증 관리 | small molecule | NaV1.8 | Vertex Pharmaceuticals | 1월 30일 |
| Symbravo | 급성 편두통 발작 완화 | small molecule | COX-2, 5-HT1B/1D | Axsome Therapeutics | 1월 30일 |
FDA 승인 조회: 주요 신약 특징
1. FDA 승인 확인 – Lumakras + Vectibix 병용 요법 (대장암 치료제)
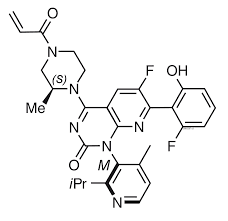
- FDA에서 승인된 대장암 치료제로는 특정 KRAS 및 EGFR 변이를 가진 환자를 대상으로 합니다.
- Lumakras는 KRAS G12C 변이를, Vectibix는 EGFR을 표적으로 하는 단클론 항체(monoclonal antibody)입니다.
- 두 약제는 병용 요법으로 FDA 승인을 받으며, 효과적인 치료 옵션으로 검증되었습니다.
2. FDA 승인 조회 – Datroway (Dato-DXd), 차세대 ADC 기반 항암제
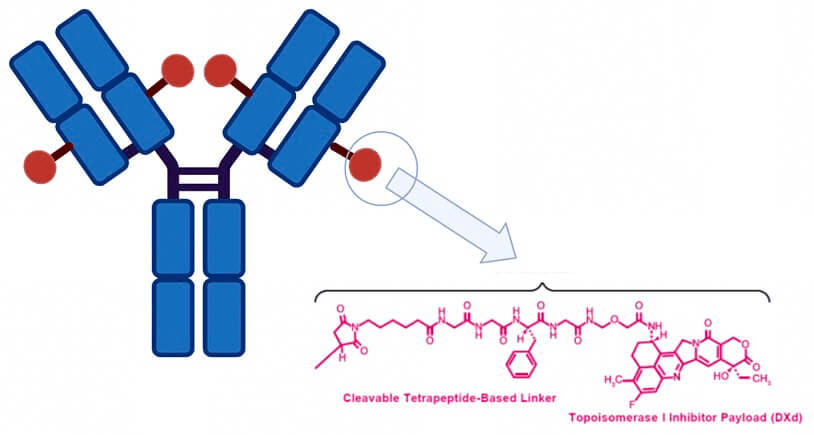
- FDA에서 승인된 항체-약물 접합체(ADC)는 HR+/HER2- 유방암 환자에게 새로운 치료 옵션을 제공합니다.
- TROP2를 표적으로 하여, 기존 치료제 대비 부작용은 줄이고 효과는 향상시켰습니다.(출처)
3. FDA 승인 – Journavx (비오피오이드 진통제)
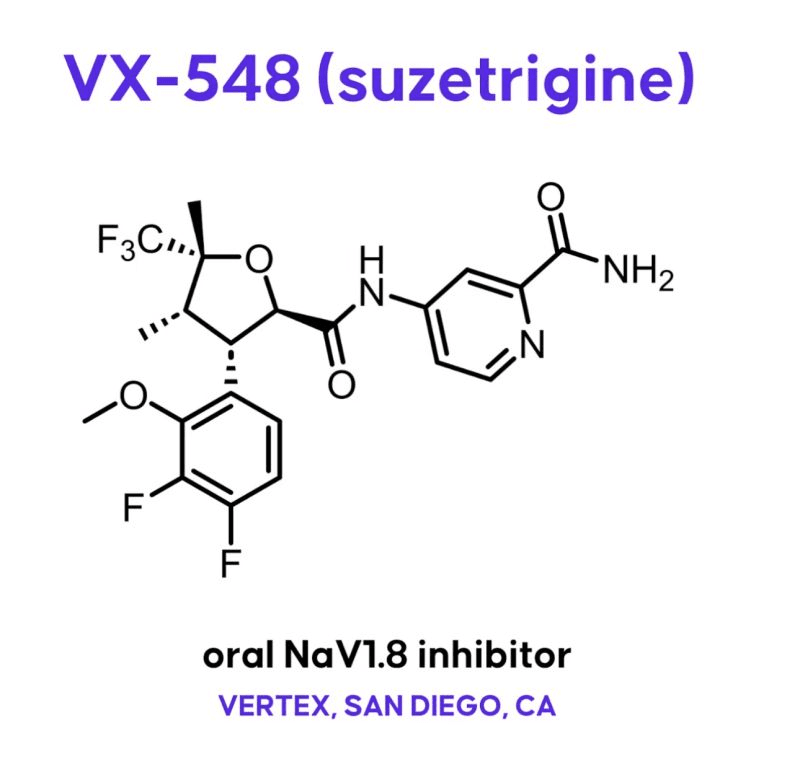
- FDA에서 승인된 비오피오이드 진통제는 기존 오피오이드 의존성 문제를 해결하는 데 기여합니다.
- NaV1.8 차단 기전을 통해 통증 신호를 효과적으로 차단하여 신경성 통증을 관리할 수 있습니다. (출처)
4. FDA 승인 조회 – Symbravo (새로운 편두통 치료제)
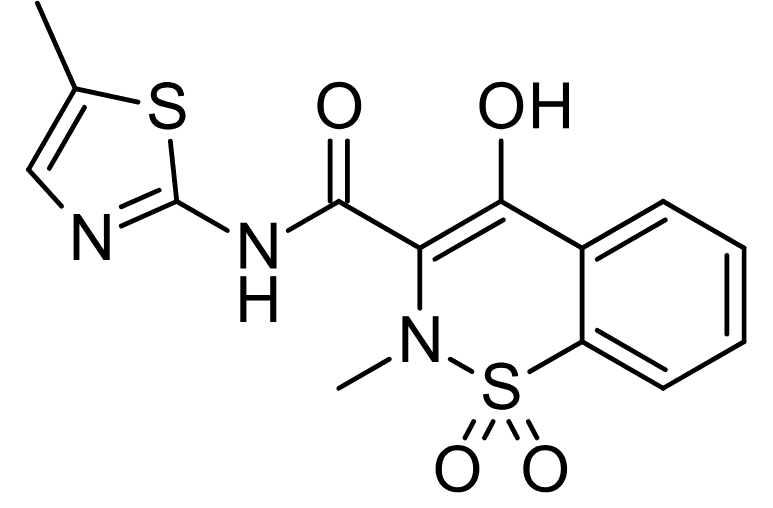
- FDA에서 승인된 최신 편두통 치료제는 NSAID(Meloxicam)와 5-HT1B/1D 작용제(Rizatriptan)의 조합입니다.
- 급성 편두통 발작 시 신속하고 지속적인 통증 완화를 제공합니다.
- 기존 치료제 대비 더 효과적이고 빠른 작용이 기대됩니다. (출처)
FDA 승인 확인 – 2025년 신약이 가져올 변화
2025년 1월 FDA 승인 조회를 통해 확인된 신약들은 다양한 질환에서 새로운 치료 옵션을 제공합니다. 특히 비오피오이드 진통제, 항체-약물 접합체(ADC), 급성 편두통 치료제 등 혁신적인 기술이 적용된 것이 특징입니다.
앞으로 이러한 신약들이 환자들에게 실질적인 혜택을 줄 것으로 기대됩니다.
📌 최신 FDA 승인 조회 및 확인은 FDA 공식 사이트에서 가능합니다.
AI 신약개발 플랫폼 하이퍼랩
- 무료체험 https://abit.ly/01cnoz
- 도입문의 https://abit.ly/yyytsg