첫 NASH(MASH) 치료제 '레즈디프라' FDA 승인 : 신흥 블록버스터 약물의 등장


NASH(MASH) 치료제 탄생! : FDA승인 완료!
세계 최초 치료제 난공불락의 영역이었던 ‘대사 이상 관련 지방간염(MASH) 치료제’가 마침내 탄생했어요.
<MASH는 기존 NASH(비알코올성 지방간염)의 새로운 명칭이에요.>
미국을 포함한 세계 주요 간질환 연구 협회는 지난해 ‘비알코올성 지방간염(NASH, nonalcoholic steatohepatitis)’의 공식 명칭을 ‘대사 이상 관련 지방간염(MASH, metabolic dysfunction-associated steatohepatitis)’으로 변경한다고 발표했어요. 1980년 NASH라는 용어가 정의된 지 43년 만에 명칭 변경이 이루어진 거죠.
또한 ‘지방간(fatty liver)’은 ‘지방성 간질환(SLD, steatotic liver disease)’으로, ‘비알코올성 지방간질환(NAFLD)’은 ‘대사 이상 연관 지방간질환(MASLD, metabolic dysfunction-associated steatotic liver disease)’으로 각각 이름이 바뀌었어요.
NASH(MASH)가 위험한 이유
NASH(현재는 MASH로 변경)는 비알코올성 지방간질환(NAFLD)의 진행된 형태로, 간 관련 사망의 주요 원인 중 하나예요. 시간이 지나면서 간에 염증이 생기고, 이게 간 섬유화나 기능 저하로 이어질 수 있어요. 또 고혈압이나 제2형 당뇨 같은 대사성 질환이 함께 발생할 가능성도 높고요.
다만, 지방간이 비대상성 간경변증까지 진행된 경우에는 레즈디프라(Resmetirom)를 사용해서는 안 된다고 미국 FDA는 밝혔어요. 이 약은 스타틴 계열 고지혈증 치료제와 상호작용이 있기 때문에, 스타틴을 복용 중이라면 반드시 의사와 상담해야 해요. 여러 차례 실패로 기대감이 낮아진 건 사실이지만, 지금도 많은 제약사들이 NAFLD와 NASH 치료제를 목표로 임상을 계속 진행 중이에요.

FDA 승인 받은 MASH치료제의 이름은 : 레즈디프라
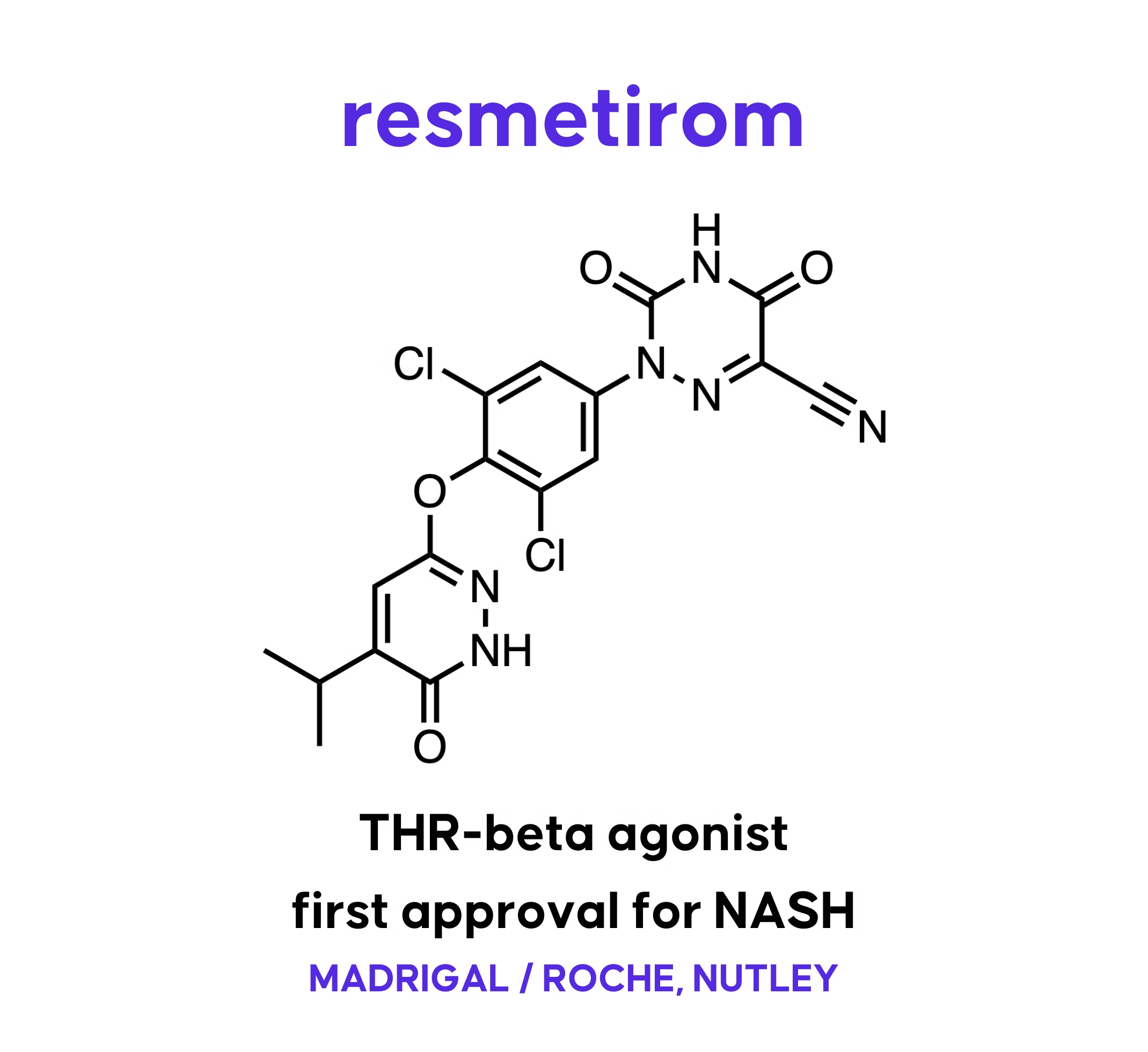
마드리갈 파마슈티컬스의 레즈디프라(성분명: 레스메티롬)는 2024년 3월, 미국 식품의약국(FDA)으로부터 신속 승인(Accelerated Approval)을 받았어요. 레즈디프라는 갑상선 호르몬 수용체 베타(THR-β) 작용제로, 간에서 THR-β 수용체를 활성화해 간에 축적된 지방을 줄여주는 기전을 갖고 있는 것으로 알려져 있어요. 이 약물의 성분은 ‘레스메티롬(Resmetirom)’이며, 아래와 같은 구조를 가지고 있어요.
NASH(MASH) 치료제를 주목해야 하는 이유
시장조사 기관 글로벌데이터에 따르면, 글로벌 MASH 치료 시장은 2026년까지 약 253억 달러(약 33조 7,375억 원) 규모에 이를 것으로 전망되고 있어요. 특히 MASH 환자 수는 계속해서 증가하는 추세고, 마드리갈은 2024년 4월부터 미국 시장에서 레즈디프라를 본격 시판할 예정이라고 해요.
회사 측은 “15년 이상 연구 끝에 얻은 결실이며, MASH 치료의 패러다임을 바꿀 수 있다”고 밝히며, 레즈디프라가 블록버스터 약물로 성장할 가능성을 자신하고 있어요. 2028년에는 최대 22억 달러 이상의 매출을 기록할 것으로 기대되고 있고, 약물의 순 가치는 60억 달러에 이를 것으로 분석됐대요.
실제로 건강보험심사평가원 자료에 따르면, 국내에서도 2021년 기준 MASH 환자가 40만 5,950명으로 집계되었고, 이는 불과 5년 사이 40% 이상 증가한 수치라고 해요. 전 세계적으로는 약 4억 4,000만 명 이상의 환자가 있는 것으로 추정되고 있고, 결과적으로 최대 33조 원 규모의 새로운 치료 시장이 형성될 것으로 보입니다.
NASH(MASH) 치료제 개발 현황
현재 레즈디프라는 효과를 검증하기 위한 54개월간의 임상시험이 진행 중이에요. FDA는 이 임상의 1년 차 중간 평가 결과를 근거로 레즈디프라를 신속 승인했어요. 다만 이번 승인은 조건부 승인으로, 향후 확증 임상 연구에서 임상적 이점이 명확히 입증돼야 정식 승인이 이뤄질 수 있어요. 아래 표는 국내 및 국외에서 개발 중인 NASH(MASH) 치료제들의 개발 현황을 정리한 내용이에요.
| 개발사 | 개발명 | 개발 현황 |
| 마드리갈 | 레스메티롬 | FDA 승인 |
| 한미약품 | 에포시페그투르타이드 | 2상 |
| 유한양행 | YH25724 | 1상 |
| 동아에스티 | DA-1241 | 2상 |
| LG 화학 | LG203003 | 1상 |
| 일동제약 | ID119031166M | 1상 |
| 개발사 | 개발명 | 개발 현황 |
| 마드리갈 | 레스메티롬 | FDA 승인 |
| 인터셉트 | 오칼리바 | 3상 종료 |
| 갈메드 | 아람콜 | 3상 |
| 노보 노디스크 | 세마글루타이드 | 3상 |
| 아케로 | 에프룩시페르민 | 2/3상 |
| 리제네론.앨나일람 | ALN-HSD | 2상 |
| 바이킹 | VK2809 | 2상 |
| MSD | 에피노페그듀타이드 | 2상 |
| 릴리 | 터제파타이드 | 2상 |
| 베링거인겔하임 | 서보두타이드 | 2상 |
‘레즈디프라’
비만약 위고비처럼 ‘레즈디프라’가 신흥 블록버스터 약물이 될수 있을까요? 제2의 노보가 될수 있을지 귀추가 주목되네요.