Rational Drug Design : 합리적 약물 설계


Rational Drug Design : 합리적 약물 설계
현재 많은 약물들은 특정 질환을 치료하기 위한 목적으로 설계되고 있습니다. 질병으로 인해 발생하는 비정상적인 생화학 또는 세포 변화가 식별되면, 특정 부위와 상호작용하여, 질병을 예방하거나 교정할 수 있는 화합물을 설계할 수 있습니다.
새로운 화합물이 가능성을 보여주는 경우, 그 구조는 보통 다음을 위해 여러 번 수정됩니다.
-
선택성 고려: 약물이 작용하고자 하는 표적에 정확히 결합하도록 하기 위해, 표적 선택성을 최적화해야 합니다.
-
친화성 고려: 표적 부위에 안정적으로 결합하고 일정 시간 동안 유지되도록 하기 위해, 결합 친화성을 높이는 것이 중요합니다.
-
유효성·효능 고려: 약물이 충분한 효과를 발휘할 수 있도록, 적절한 함량과 활성 수준을 조절하여 유효성을 최적화해야 합니다.
-
부작용 고려: 인체에 미치는 불필요한 영향이나 독성을 최소화하기 위해, 약물의 안전성을 함께 고려해야 합니다.
이 외에도, 화합물이 생체 내 장벽을 통해 얼마나 잘 흡수되는지, 그리고 신체 조직이나 체액 내에서 얼마나 안정적인지도 중요한 고려 요소입니다.
이러한 요소들은 신체가 약물에 미치는 영향(약물동태학, Pharmacokinetics)과 약물이 신체에 미치는 영향(약물동력학, Pharmacodynamics)과 밀접한 관련이 있습니다.
Rational Drug Design의 시작 : 생물학적 시스템 이해
합리적인 약물 설계의 기반은 생물학적 시스템을 이해하는 것에서 시작됩니다.
i) Lock-and-Key Model
Lock and Key 모델은 단백질이 약물을 받아들일 수 있도록, 이미 고정된 구조의 결합 부위(binding site)를 가지고 있다고 가정합니다. 이는 마치 특정 자물쇠에 꼭 맞는 열쇠가 있어야 자물쇠를 열거나 잠글 수 있는 원리와 유사합니다.
ii) Induced-Fit Model
단백질의 유동성이라는 중요한 특성을 반영하여 등장한 개념이 바로 Induced Fit 모델입니다. 이 모델에 따르면, 단백질과 약물은 상호작용을 통해 서로의 구조에 변화를 일으키며, 에너지적으로 더 안정된 결합 구조를 형성하게 됩니다. 나아가, 단백질이 가질 수 있는 여러 구조 중 약물과 가장 잘 맞는 형태로 변화하여 결합하게 됩니다.
자세한 설명은 <이전 글 ‘가상탐색을 위한 단백질 구조 선정 방법’을 참고하세요>
Drug Design Process는 일반적으로 세 단계로 진행됩니다. 먼저 화합물을 설계하고, 이후 이를 실제로 합성하며, 마지막으로 생물학적 활성을 실험을 통해 확인합니다. 이 과정을 반복하는 추가적인 라운드를 거치면서, 화합물의 구조를 점차 최적화할 수 있습니다.
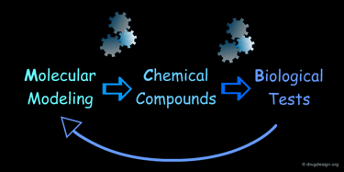
Drug Design : 2가지 접근 방식
A) "structure-based", "receptor-based", "target-based" or "direct" drug design
표적 단백질의 3차원 구조가 알려져 있을 때 적용할 수 있는 직접적인 약물 설계 방법입니다. 이러한 설계는 리간드와 단백질 간의 복합체 구조, 그리고 컴퓨터 기반의 분자 설계 기술을 바탕으로 수행됩니다.
자세한 설명은 <이전 글 ‘구조 기반 신약 개발에서 Binding site 탐색과 정의 방법’을 참고하세요>
B) "pharmacophore-based", "ligand-based" or "indirect" drug design
표적 단백질의 3차원 구조를 이용할 수 없는 경우에는, 이미 알려진 활성 분자의 정보를 바탕으로 간접적인 약물 설계가 가능합니다. 이러한 방식은 활성 및 비활성 화합물의 입체화학적(stereochemical) 및 물리화학적(physicochemical) 특성을 기반으로 수행됩니다. 이상적인 설계 방식은 구조 기반 방법과 리간드 기반 방법(A/B 방법)을 독립적으로 결합하여 활용하는 것으로, 두 접근 방식 간의 시너지 효과를 기대할 수 있습니다.
Drug design : Ligand-based design
이제 본격적으로, Ligand-based Design을 기반으로 한 약물 설계(Drug Design)에 대해 살펴보겠습니다. Ligand-based 디자인의 성공 여부는 축적된 지식과 데이터를 얼마나 효과적으로 분석하느냐에 달려 있습니다. 물론, 이러한 정보를 바탕으로 창의력과 상상력을 발휘해 지능적인 분자(화합물)로 변환해내는 과정이 무엇보다 중요합니다.
이번에는 Ligand-based Design에서 널리 활용되는 대표적인 두 가지 방법을 소개하겠습니다.
1) chemical modifications
Lead 화합물의 특정부위를 bioisosteric replacement, design of rigid analogs, homologation of alkyl chains, alteration of ring size 조절로 변경하면서 구조를 변화시킬 수 있습니다.
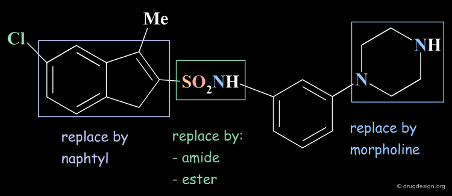
특히, Bioisosteric replacements는 물리적 성질이 비슷한 화학군으로써 설계된 분자들은 생물학적 성질이 비슷할 것으로 예상하고 진행하는 가장 우선하여 접근하는 방법입니다.

위 방법의 핵심은 합성된 구조와 활성 상관 관계(structure–activity relationship (SAR)) 을 이해하면서 데이터를 축적해가야 구조를 체계적으로 디자인할 수 있습니다.
참고) SAR analysis
새로운 활성 화합물이 분자 구조의 변화를 통해 확인되면, 이를 바탕으로 유사하거나 향상된 활성을 가진 새로운 화합물을 설계하고 결정할 수 있습니다. 이러한 과정은 생물학적 활성과 분자 구조 간의 상관관계를 분석하는 것으로, 구조-활성 상관관계(SAR, Structure-Activity Relationship)라고 합니다.

1-2) Manual Design
많은 의약화학자들은 일반적으로 컴퓨터를 사용하지 않고, 이전에 실험을 통해 얻은 분자 정보를 바탕으로 새로운 화합물을 설계하는 방식을 사용하고 있습니다. 이러한 방식은 축적된 실험 데이터를 충분히 활용하여, 목표로 하는 분자를 직접 디자인하고 합성하는 데 중점을 둡니다. 디자인 스케치를 위한 최소한의 구조적 변경 요소로는 작용기의 회전(rotation), 삭제(deletion), 추가(addition), 융합(fusion), 연결(connection), 비틀림 각도 조절(torsional angle alteration), 중첩(superimposition) 등이 있습니다.
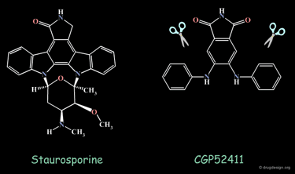
CGP52411의 구조를 기반으로 pharmacophore 형태를 분석하여 pyrrolopyrimidine 유도체를 설계하고 합성하였습니다. 그 결과, 해당 화합물의 활성을 평가한 실험에서 IC50 = 0.025 µM의 우수한 활성을 나타냈으며, 여러 유도체 시리즈 중에서도 잠재력 있는 후보 물질로 선정되었습니다.
2) 3D Shape Searching
참고 분자(Reference molecule)와 유사한 3차원 형태, 즉 Pharmacophore shape query를 정의한 후, 이를 기반으로 가상 스크리닝이나 de novo design에 활용하는 방법입니다. 일반적으로 사용되는 pharmacophore 특징에는 hydrophobic centroid, aromatic ring, hydrogen bond acceptor, hydrogen bond donor, 양이온(cation), 음이온(anion) 등이 포함됩니다. 이러한 특징들이 명확하게 정의되어 있을수록, 새로운 리간드(novel ligand)를 탐색하는 데 있어 핵심적인 역할을 하게 됩니다.
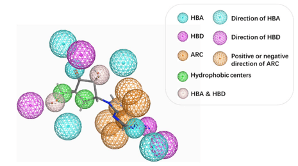
하지만 형태는 비슷해도 화학적 구조에는 큰 차이가 있을 수 있습니다. (아래의 그림 참고)

약물 갖춰야 할 특성
결국 다양한 방법으로 설계되고 디자인 된 이상적인 약물의 특성은 다음을 만족하여야 합니다.
- 표적 부위에 대해 높은 선택성을 가져야 합니다. (부작용의 최소화)
- 강력하고 효과적인 효능을 보여야 합니다. (저용량 가능성)
- 경구 투여 시에도 효과적으로 작용해야 합니다. (편리한 약물복용)
- 신체 조직과 체액 내에서 안정성을 유지해야 합니다. (하루 한 번 복용으로 긴 작용시간)
Rational Drug Design 글을 마치며
하지만 연령, 체중, 유전적 구성, 그리고 특정 질환의 유무 등 다양한 생물학적 요인들이 약물 반응에 영향을 미칠 수 있습니다. 따라서 약물 설계는 단순한 화학 구조의 변형에만 머물러서는 안 되며, 약물의 전반적인 특성과 체내에서의 행동까지 함께 고려해야 합니다. 히츠의 신약개발 플랫폼인 하이퍼랩(HyperLab)에는 이러한 과정을 지원하는 ‘하이퍼 디자인’ 기능이 탑재되어 있습니다. 단백질 구조를 기반으로 최적의 화합물을 추천하고, ADMET 예측 데이터를 함께 제공하여 더 정밀한 설계를 가능하게 합니다. 하이퍼랩이 제공하는 체계적인 환경 속에서, 여러분의 구조적 아이디어가 더욱 구체적이고 정밀하게 발전하길 기대합니다.